ОТ ГЛАВНОГО РЕДАКТОРА
АКТУАЛЬНЫЕ ОБЗОРЫ
Что уже известно об этой теме?
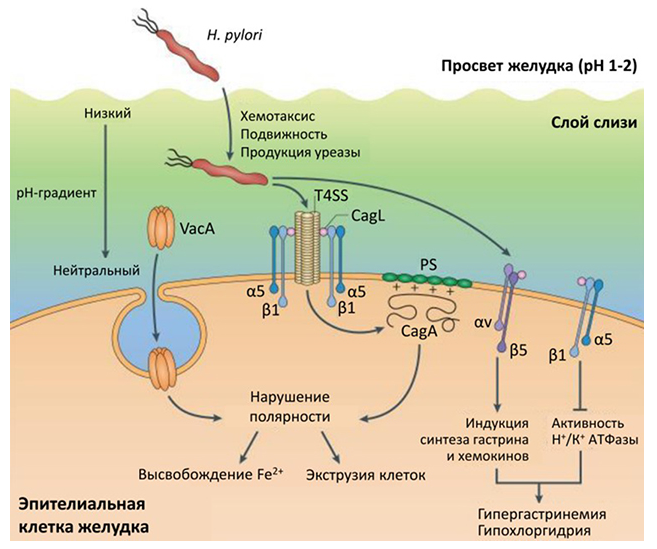
Роль H. pylori: Helicobacter pylori — широко распространённая инфекция, являющаяся главной причиной хронического гастрита, язвенной болезни и рака желудка (РЖ). Она признана канцерогеном I группы.
Процесс канцерогенеза: длительная персистенция H. pylori запускает каскад патологических изменений слизистой оболочки желудка (СОЖ) — от воспаления до атрофии, метаплазии, дисплазии и рака (каскад Корреа).
Значение эрадикации: своевременная эрадикация H. pylori — это эффективная мера первичной профилактики РЖ, которая может предотвратить или обратить вспять предраковые изменения.
Роль ИПП: ингибиторы протонной помпы (ИПП) — ключевой компонент эрадикационной терапии, повышающий эффективность антибиотиков.
Влияние фармакогенетики: метаболизм большинства ИПП (омепразол, лансопразол, пантопразол) зависит от фермента CYP2C19, полиморфизм гена которого определяет скорость их расщепления и, следовательно, эффективность.
Что нового даёт статья?
Акцент на российскую популяцию: в статье приводятся данные о высокой распространённости аллеля CYP2C1917 (повышенная функция фермента) в России, что предрасполагает к низкой эффективности стандартных доз ИПП у значительной части населения.
Сравнительный анализ ИПП: подчёркивается, что рабепразол в наименьшей степени зависит от полиморфизма CYP2C19, тогда как на омепразол, лансопразол и пантопразол он влияет значительно.
Конкретные рекомендации: обсуждаются международные (DPWG) рекомендации по увеличению доз ИПП для пациентов с быстрым и ультрабыстрым метаболизмом (RM/UM).
Призыв к персонализации: статья обобщает данные, подтверждающие, что фармакогенетическое тестирование (ФГТ) CYP2C19 является практичным инструментом для преодоления неэффективности терапии, особенно в популяциях с высокой частотой "быстрых" метаболизаторов.
Как это может повлиять на клиническую практику в обозримом будущем?
Внедрение ФГТ в рутину: фармакогенетическое тестирование на полиморфизм гена CYP2C19 может стать стандартным предтерапевтическим обследованием перед назначением эрадикационной терапии, особенно в регионах с высокой распространённостью аллеля *17 (как в России).
Персонализированный выбор ИПП и дозы:
Для пациентов с фенотипами RM/UM будет обосновано назначение повышенных доз ИПП первого поколения или, что более предпочтительно, выбор рабепразола/эзомепразола с меньшей зависимостью от CYP2C19.
Для пациентов с фенотипами IM/PM стандартные дозы ИПП будут признаны адекватными.
Повышение эффективности эрадикации: такой подход позволит с первого курса назначать максимально эффективную терапию, снижая риск неудач, развития резистентности и прогрессирования предраковых заболеваний.
Изменение клинических рекомендаций: локальные (национальные) клинические рекомендации могут быть дополнены разделами по фармакогенетике для оптимизации антихеликобактерной терапии.
Актуальность. Инфекция Helicobacter pylori является ключевым фактором риска развития рака желудка, а её эрадикация рассматривается как мера первичной профилактики. Ингибиторы протонной помпы (ИПП) — основа эрадикационной терапии, однако их эффективность в значительной степени зависит от генетического полиморфизма фермента CYP2C19, ответственного за их метаболизм.
Цель. Обобщить и представить данные современных исследований о влиянии генетического полиморфизма CYP2C19 на эффективность эрадикационной терапии H. pylori.
Материалы и методы. Проведён обзор литературы в отечественных и зарубежных базах данных (РИНЦ, PubMed, ResearchGate) по следующим ключевым словам: «полиморфизм CYP2C19», «метаболизм ингибиторов протонной помпы», «эрадикация Helicobacter pylori». Проанализированы 41 публикаций, наиболее соответствующих теме исследования.
Результаты. Метаболизм ИПП первого поколения (омепразол, лансопразол, пантопразол) в значительной степени зависит от активности CYP2C19.
В зависимости от генотипа CYP2C19 пациенты классифицируются на фенотипы метаболизма: ультрабыстрый (UM), быстрый (RM), нормальный (NM), промежуточный (IM) и медленный (PM). Данные, преимущественно полученные в азиатских популяциях, свидетельствуют, что фенотипы NM и RM/ UM ассоциированы с более низкими показателями эрадикации из-за ускоренного метаболизма ИПП и снижения их экспозиции, в то время как фенотипы IM и PM демонстрируют более высокую эффективность. В российской популяции отмечается высокая частота аллеля быстрого метаболизма CYP2C19*17, что предполагает потенциально недостаточный ответ на стандартные дозы ИПП. Рабепразол и эзомепразол в меньшей степени зависят от CYP2C19, что обеспечивает более стабильную эффективность у пациентов с разными генотипами. Клинические рекомендации (CPIC, DPWG) предлагают использовать генотипирование CYP2C19 для персонализации доз ИПП.
Заключение. Генетический полиморфизм CYP2C19 является важным фактором, определяющим фармакокинетику ИПП и эффективность эрадикации H. pylori. Фармакогенетическое тестирование CYP2C19 может служить полезным инструментом для персонализации антихеликобактерной терапии, особенно в популяциях с высокой распространённостью аллелей быстрого метаболизма, позволяя выбирать оптимальный ИПП и его дозу для преодоления рефрактерности и повышения эффективности лечения.
КЛИНИЧЕСКАЯ ФАРМАКОГЕНЕТИКА
Что уже известно об этой теме?
Токсичность высокодозного метотрексата (МТХ) при лечении ОЛЛ у детей — серьезная и актуальная проблема.
Развитие токсичности имеет многофакторную природу и демонстрирует значительную межиндивидуальную вариабельность.
Роль транспортерных белков, кодируемых генами ABCB1 и SLCO1B1, в фармакокинетике и токсичности МТХ подтверждена ранее проведенными исследованиями.
Полиморфизмы в этих генах связывают с изменением концентрации МТХ и риском развития нежелательных реакций (например, нейтропении, мукозита).
Что нового даёт статья?
В российской педиатрической популяции пациентов с ОЛЛ подтверждена связь конкретных полиморфизмов с профилем безопасности МТХ:
ABCB1 rs1128503 (CC) — ассоциирован с повышенным риском орофарингеального мукозита.
SLCO1B1 rs4149056 (TT) — ассоциирован с повышенным риском инфекционных осложнений.
ABCB1 rs1045642 (TT) — показал возможную связь с нейро- и нефротоксичностью (требует дальнейшего изучения).
Выявлено, что выраженная гепатотоксичность, гематотоксичность и мукозит статистически значимо увеличивают частоту инфекционных осложнений.
Подчеркнута чувствительность результатов к методам статистической коррекции (Bonferroni vs. FDR), что важно для интерпретации фармакогенетических исследований.
Как это может повлиять на клиническую практику в обозримом будущем?
Результаты обосновывают необходимость проведения масштабных фармакогенетических исследований перед внедрением персонализированных подходов в рутинную практику.
В перспективе, досимптомное генотипирование полиморфизмов ABCB1 и SLCO1B1 может помочь выделить группу пациентов с высоким риском тяжелых нежелательных реакций (мукозит, инфекции).
Это позволит проводить более тщательный мониторинг, своевременную профилактику или коррекцию терапии для таких пациентов, потенциально повышая безопасность лечения.
Для повышения точности прогноза необходимы дальнейшие исследования с учетом гаплотипов, ковариат и включением генов ферментов метаболизма МТХ.
Обоснование. Высокие дозы (1–5 г/м2) метотрексата (МТХ) занимают одно из ведущих мест в программах терапии острого лимфобластного лейкоза (ОЛЛ) у детей. Межиндивидуальная вариабельность токсичности МТХ является наиболее актуальным направлением современных исследований, направленных на повышение безопасности терапии, не снижая при этом её эффективность. Поскольку метаболиты МТХ имеют сродство к P-гликопротеину, возможно влияние полиморфных вариантов гена ABCB1 на безопасность данного препарата.
Цель исследования. Оценить роль полиморфизмов генов ABCB1 (C3435T, C1236T, 2677G>T/A, rs4148738 С>T), SLCO1B1 T521C на профиль безопасности метотрексата у детей с ОЛЛ.
Материалы и методы. В исследование включены 124 пациента с установленным диагнозом ОЛЛ (С91.0 по МКБ-10), получавших терапию высокодозным метотрексатом (>1 г/м2). Для определения степеней нежелательных реакций (НР) применялись лабораторные методы с использованием критериев токсичности NCI (CTCAE v5.0 2018 года). Носительство полиморфных вариантов проводилось методом аллель-специфической полимеразной цепной реакции (ПЦР) в режиме реального времени. Для статистической обработки результатов использовалась программа SPSS Statistics 26.0 (США).
Результаты. По результатам проведённого анализа безопасности терапии высокодозным МТХ установлено: полиморфный вариант ABCB1 1236C>T является значимым предиктором развития орофарингеального мукозита при терапии МТХ, большая выраженность НР показана для гомозигот CC.
У пациентов с генотипом TT гена SLCO1B1 T521C rs4149056 повышен риск развития выраженных инфекционных осложнений в 2,7 раза, у пациентов с генотипом TT гена ABCB1 C3435T определяется повышенный риск развития нефротоксичности (p = 0,035, ОШ: 8,3 (95 % ДИ: 0,83–82,2) и нейротоксичности (p = 0,041, ОШ: 2,3 (95 % ДИ: 1,02–5,12).
Заключение. На основании результатов проведённого анализа безопасности терапии высокодозным МТХ показана необходимость проведения масштабного фармакогенетического тестирования перед попытками внедрения в реальную клиническую практику.
Что уже известно об этой теме?
Проблема лечения: лечение туберкулёза с множественной (МЛУ) и широкой (ШЛУ) лекарственной устойчивостью остается сложной задачей, а его эффективность (54% в РФ) значительно ниже целевых показателей ВОЗ (80%).
Роль фармакогенетики: ответ на терапию зависит как от фенотипических (возраст, сопутствующие болезни и т.д.), так и от генетических факторов, влияющих на метаболизм и транспорт препаратов.
Недостаток данных: в то время как для чувствительного туберкулёза некоторые фармакогенетические маркеры (например, NAT2 для изониазида) известны, для современных режимов лечения МЛУ/ШЛУ-ТБ персонализированные подходы не разработаны, а биомаркеры практически не изучены.
Что нового даёт статья?
Выявлены новые маркеры эффективности: впервые в ходе клинического исследования у пациентов с МЛУ/ШЛУ-ТБ выявлены два конкретных генетических полиморфизма, достоверно связанных с низкой эффективностью лечения:
Гомозиготный генотип AA в гене CYP3A5 (rs776746).
Гомозиготный генотип AA в гене ABCG2 (rs2231142).
Выявлены маркеры безопасности: обнаружены полиморфизмы, ассоциированные с риском развития конкретных нежелательных реакций (НР):
Нейротоксичность: связана с "диким" генотипом GG в гене ABCB1 (rs2032582).
Гастроинтестинальные реакции: связаны с гомозиготным генотипом TT в гене ABCB1 (rs1128503).
Протективный эффект: полиморфизм в гене SLCO1B1 (rs4149056) снижал риск развития артралгий.
Предложен состав фармакогенетической панели: определён конкретный набор генов (CYP3A5, ABCG2, ABCB1, SLCO1B1), анализ которых может быть полезен для прогнозирования исхода лечения.
Как это может повлиять на клиническую практику в обозримом будущем?
Персонализация терапии: в будущем, при подтверждении результатов на более крупных выборках, генетическое тестирование позволит до начала лечения выявлять пациентов с высоким риском неудачи терапии (носителей CYP3A5 AA и ABCG2 AA).
Коррекция лечебной тактики: для таких пациентов можно будет сразу планировать более длительные или усиленные режимы химиотерапии, чтобы повысить шансы на успех.
Профилактика осложнений: выявление пациентов с генетическим риском специфических НР (например, нейротоксичности) позволит проводить направленный мониторинг и своевременно проводить профилактику или коррекцию доз, улучшая переносимость лечения.
Создание алгоритмов: результаты работы закладывают основу для разработки клинических рекомендаций по применению фармакогенетического тестирования у пациентов с МЛУ/ШЛУ-ТБ.
Актуальность. Лечение больных туберкулёзом (ТБ) с множественной лекарственной устойчивостью (МЛУ) возбудителя часто осложняется нежелательными реакциями (НР) с вынужденной отменой препаратов, его эффективность далека от целевых показателей и зависит от ряда факторов, в том числе генетических особенностей пациента. Фармакогенетические маркеры МЛУ-ТБ не изучены; ожидается, что их выявление позволит улучшить результаты лечения на основе персонализированного подхода.
Цель. Определить фармакогенетические маркеры, связанные с эффективностью и безопасностью лечения больных туберкулёзом с МЛУ возбудителя.
Методы. В проспективное когортное исследование включено 40 пациентов больных с МЛУ-туберкулёзом без ВИЧ-инфекции, получавших терапию по режимам с включением бедаквилина, линезолида и фторхинолона в 2023–2024 гг. У всех пациентов однократно независимо от сроков терапии осуществляли забор 3–5 мл венозной крови; методом ПЦР в реальном времени определяли наличие однонуклеотидных полиморфизмов генов цитохромов (CYP3A4, CYP3A5), Р-гликопротеина (ABCB1), мембранного АТФ-связывающего кассетного транспортёра (ABCG2), транспортёра органических анионов (SLCO1B1), отобранных на основе анализа литературы и базы PharmGKB. Оценивали их взаимосвязь с показателями эффективности и безопасности лечения с помощью одномерного анализа, с расчётом отношения шансов (ОШ) и его 95 % доверительного интервала (95 % ДИ).
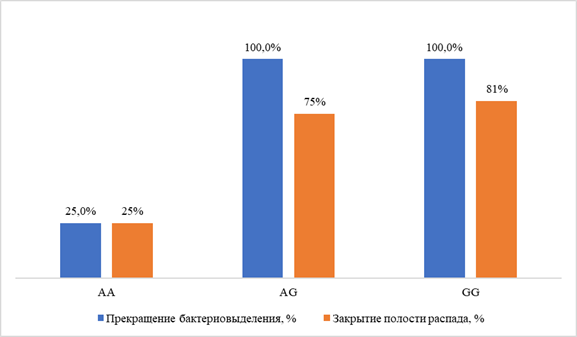
Результаты исследования. Определены целевые полиморфизмы: SLCO1B1 (rs4149056 — у 25,8 %), ABCB1 (rs1045642 — у 75,0 %, rs2032582 — 72,2 %, rs1128503 — 77,8 %), ABCG2 (rs2231142 — у 24,3 %), CYP3A4 (rs2740574 — у 8,1 %), CYP3A5 (rs776746 — у 10,8 %). Эффективность лечения по критерию прекращения бактериовыделения составила 89,3 % (95 % ДИ 72,0–97,1 %); частота НР — 70 % (95 % ДИ 54,5–82,0 %), преобладали нейротоксические реакции (у 11 из 40 больных, 27,5 %). Генотипы АА гена CYP3A5 rs776746 и АА гена ABCG2 rs2231142 ассоциировались с минимальной частотой прекращения бактериовыделения: соответственно, у 33 % и 0 % лиц с каждым вариантом по сравнению со 100 % у остальных, р < 0,01; ОШ 0,021 (95 % ДИ 0,001–0,77) и 0,083 (95 % ДИ 0,01–0,98). Риск нейротоксических реакций был выше при наличии «дикого» варианта (генотип GG) гена ABCB1 rs2032582 (55,6 % против 16,0 % у больных с аллельными полиморфизмами, р = 0,034; ОШ 6,3; 95 % ДИ 1,2–33,3); гастроинтестинальных реакций — при наличии генотипа ТТ гена ABCB1 rs1128503 (50,0 % против 10,0 %, р = 0,045; ОШ = 9,0; 95 % ДИ 1,22–66,2 %).
Заключение. Выявлены полиморфизмы генов CYP3A5 (rs776746, генотип АА) и ABCG2 (rs2231142, генотип АА), связанные с неблагоприятными результатами лечения больных МЛУ-ТБ. Определены генетические предикторы нейротоксических и гастроинтестинальных реакций при лечении больных с МЛУ возбудителя.
ПЕРСОНАЛИЗИРОВАННАЯ ТЕРАПИЯ
Что уже известно об этой теме?
Ревматоидный артрит (РА) — хроническое аутоиммунное заболевание, а метотрексат (МТ) является основным базисным препаратом для его лечения.
Эффективность МТ ограничена: около 30% пациентов не отвечают на терапию из-за недостаточной эффективности или побочных эффектов.
Основная проблема — отсутствие надежных инструментов для прогнозирования ответа на МТ до начала лечения.
Ведутся исследования по поиску генетических маркеров (однонуклеотидных полиморфизмов, SNP), связанных с механизмом действия МТ.
Что нового даёт статья?
Разработана и валидирована новая фармакогенетическая модель для прогнозирования неответа на терапию метотрексатом.
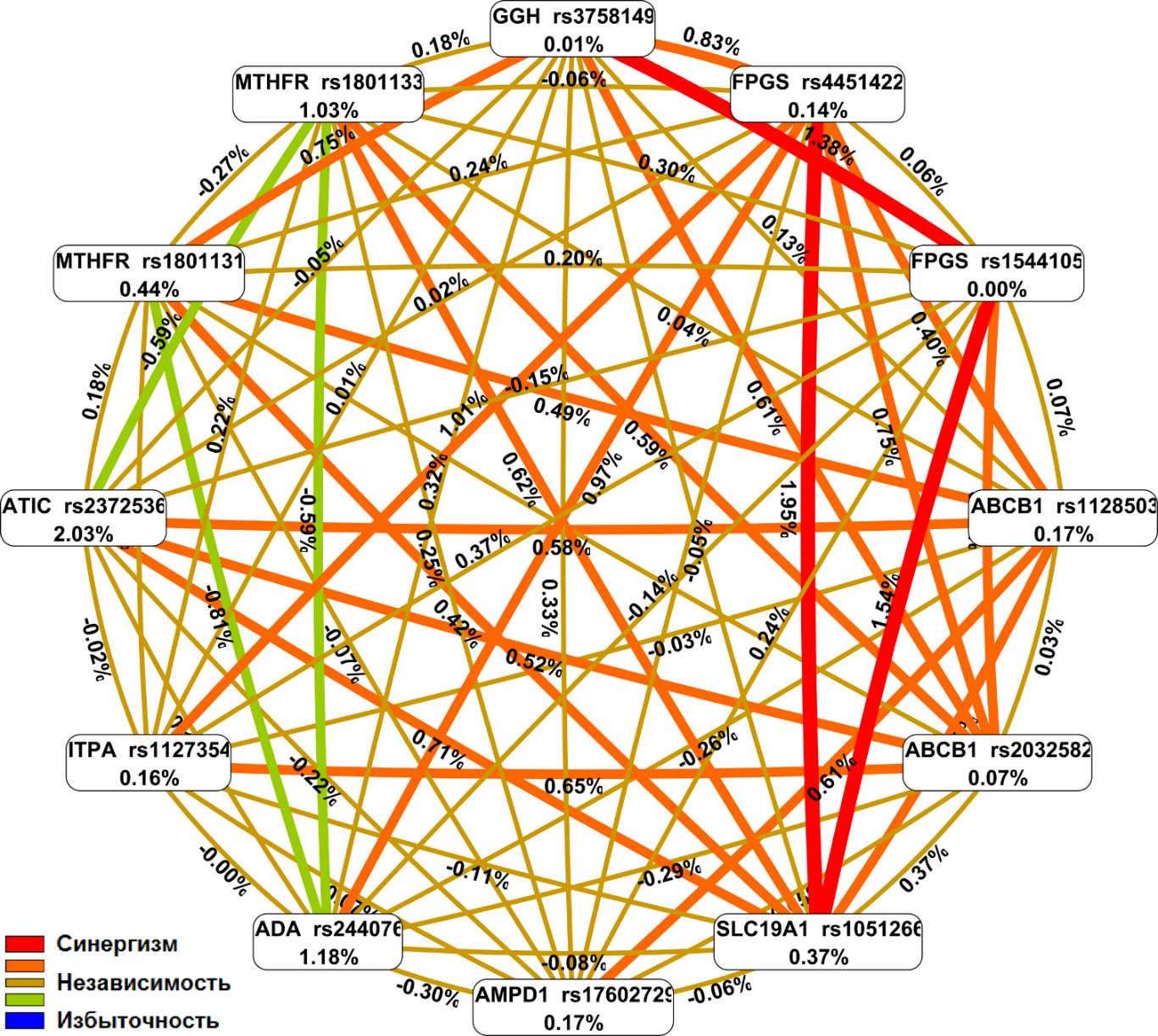
Модель включает комбинацию из пяти полиморфизмов в генах: ATIC rs2372536, MTHFR rs1801133, ADA rs244076, MTHFR rs1801131 и SLC19A1 rs1051266.
Показано, что учет биохимических путей метаболизма МТ (фолатного и аденозинового) критически важен для создания эффективной модели, в отличие от чисто математического подхода.
Модель обладает высокой чувствительностью (80.2%) и стабильностью (устойчива при кросс-валидации 10/10).
Для практического применения модели разработана отечественная тест-система и создано программное обеспечение с "если-то" решающими правилами.
Как это может повлиять на клиническую практику в обозримом будущем?
Внедрение этой модели позволит перейти к персонализированному подходу в лечении РА.
Врач сможет до начала терапии с помощью генетического теста оценить вероятность ответа пациента на метотрексат.
Это позволит:
Пациентам с высоким прогнозируемым риском неответа быстрее назначать альтернативную терапию (биологические препараты, ингибиторы Янус-киназы), не теряя время на неэффективный МТ.
Повысить общую эффективность лечения и скорость достижения ремиссии.
Снизить риск неоправданных побочных эффектов у пациентов, которым МТ не поможет.
Актуальность. Неэффективность метотрексата (МТ) у 30 % пациентов с ревматоидным артритом (РА) и связанные с ним побочные действия ограничивают эффективность лечения, диктуя необходимость разработки инструментов прогнозирования терапевтического ответа [1]. Отсутствие надёжных фармакогенетических моделей сдерживает развитие персонализированного подхода к лечению РА.
Цель. Разработать фармакогенетическую модель прогнозирования риска неответа на МТ у пациентов с РА на основе полиморфизмов генов ключевых белков, участвующих в метаболизме фармпрепарата.
Методы. В проспективное когортное исследование включён 281 пациент с РА. Параметры отбора: подтверждённый диагноз РА по критериям Европейского альянса ассоциаций ревматологов и назначение МТ в качестве стартового базисного противовоспалительного препарата. Через 6 месяцев лечения оценивался терапевтический ответ по индексу активности DAS28 (Disease Activity Score-28), выделены группы «ответчики» — 170 пациентов и «неответчики» — 111 пациентов. Проведено генотипирование полиморфизмов SLC19A1 (rs1051266), ABCB1 (rs1128503, rs2032582), GGH (rs3758149), FPGS (rs4451422, rs1544105), MTHFR (rs1801131, rs1801133), ATIC (rs2372536), ADA (rs244076), AMPD1 (rs17602729), ITPA (rs1127354). Используя методы снижения многофакторной размерности (MDR) и информационного анализа (энтропия Шеннона), разработаны модели прогнозирования эффективности МТ.
Результаты. Итоговая модель прогноза риска неответа на МТ объединяет пять однонуклеотидных полиморфизмов «ATIC rs2372536 + MTHFR rs1801133 + ADA rs244076 + MTHFR rs1801131 + SLC19A1 rs1051266», обеспечивает чувствительность 80,2 %, специфичность 69,4 % (OR 9,18 [95 % ДИ 5,19; 16,22] и обладает высокой устойчивостью в кросс-проверке (10/10).
Заключение. Разработанная пятигенная модель демонстрирует высокую диагностическую эффективность для прогнозирования неответа на МТ при РА. Практическое применение модели реализуется с помощью решающего правила «если, то».
КЛИНИЧЕСКИЙ СЛУЧАЙ
Что уже известно об этой теме?
Стандартный подход: исторически лечение муковисцидоза (МВ) было симптоматическим (поддерживающая терапия, ферменты, борьба с инфекциями).
Революция в лечении: появление таргетных модуляторов CFTR (ивакафтор, люмакафтор, тезакафтор, элексакафтор) изменило подход, позволив воздействовать на причину болезни.
Проблема взаимодействий: эти препараты подвержены сложным лекарственным взаимодействиям через систему цитохрома P450 (CYP3A) и транспортные белки (OATP1B1, P-gp), что требует осторожности при назначении.
Генетический фон: известно, что полиморфизмы в генах, кодирующих эти ферменты и транспортеры (например, CYP3A5, SLCO1B1), могут влиять на метаболизм многих лекарств.
Что нового даёт статья?
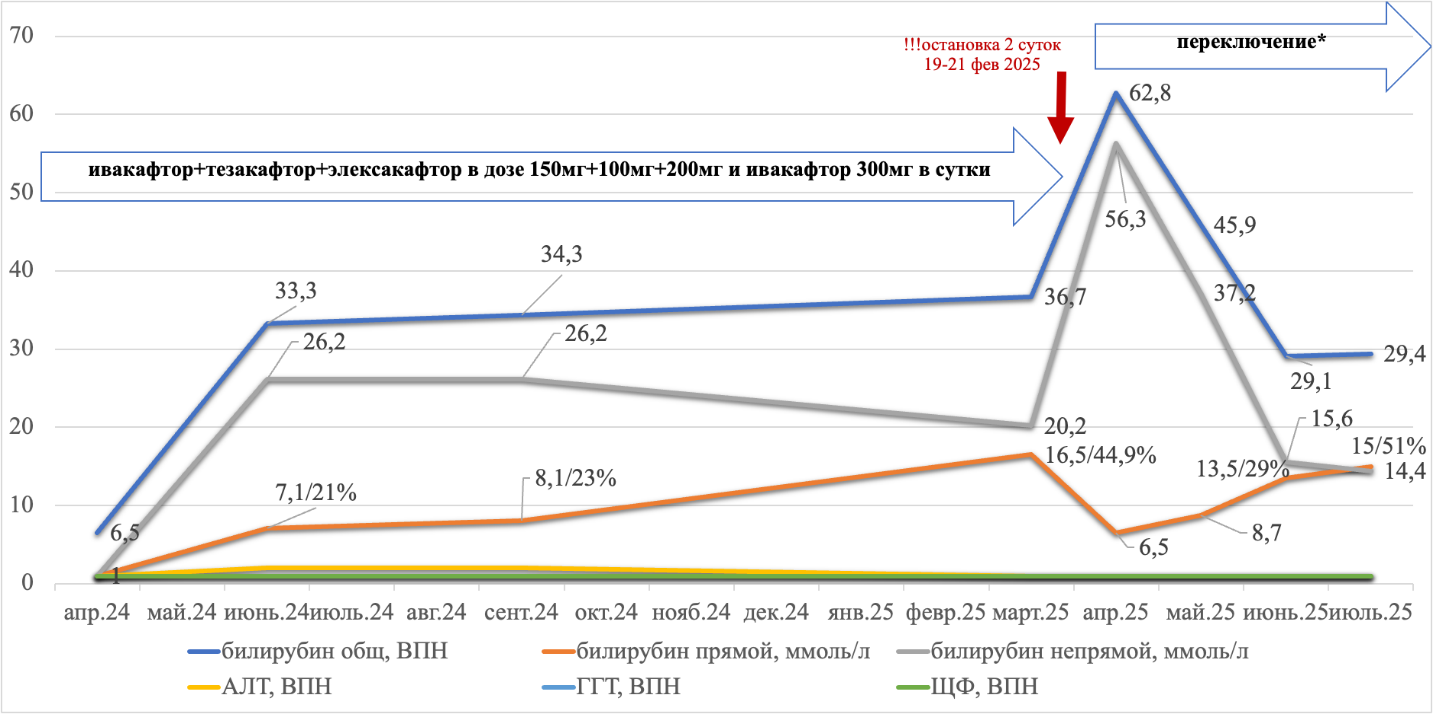
Клинический случай-доказательство: в статье представлен конкретный случай пациента с МВ, у которого развились гепатотоксичность и колебания билирубина на фоне приёма модуляторов CFTR.
Выявление генетической причины: с помощью фармакогенетического тестирования у пациента было выявлено "проблемное" сочетание генотипов CYP3A5 *3/*3 и SLCO1B1 *1/*5, объясняющее нарушение метаболизма препаратов и повышенный риск токсичности.
Персонализированный подход: на основе генетического теста был разработан индивидуальный план действий, включающий избегание конкретных препаратов, продуктов и необходимость коррекции доз.
Как это может повлиять на клиническую практику в обозримом будущем?
Внедрение фармакогенетического тестирования: статья обосновывает целесообразность рутинного фармакогенетического тестирования (на гены CYP3A5, SLCO1B1) у пациентов с МВ перед началом или при проблемах с таргетной терапией.
Повышение безопасности лечения: такой подход позволит прогнозировать и предотвращать нежелательные реакции (например, гепатотоксичность) до их возникновения, делая терапию модуляторами CFTR более безопасной.
Создание персонализированных схем: врачи смогут на основе генетического паспорта пациента давать конкретные рекомендации по избеганию взаимодействующих препаратов и, при необходимости, сразу назначать персонализированные дозы, улучшая переносимость и приверженность лечению.
Актуальность. Изучение фармакокинетических и фармакодинамических лекарственных взаимодействий с участием компонентов таргетных лекарственных препаратов, демонстрирует недостаточность имеющихся данных и значительную потребность в исследованиях, направленных на описание вероятности, степени и клинического влияния предложенных лекарственных взаимодействий для отдельного пациента и для популяции пациентов с муковисцидозом.
Цель. Описать клинический случай пациента с муковисцидозом F508del в гене CFTR в сочетании с ПИДС (Общей вариабельной иммунной недостаточностью) — носителя потенциально «проблемного» для метаболизма печени генотипа CYP3A5 *3/*3 и SLCO1B1 *1/*5 с оценкой безопасности проводимой таргетной терапии муковисцидоза.
Материалы и методы. Для генетического анализа выделенные ДНК исследованы с помощью панели iPLEX Pro PGx (Agena Bioscience) в модификации «VeriDose® Core Panel», выявлено у пациента: P-гликопротеина (P-gp) ген ABCB1 (rs1045642) G/G, APOE E2/E3, CYP1A2*1A/*1F, CYP2B6*1/*1, CYP2C19*1/*1, CYP3A4*1/*1, CYP3A5*3/*3, PNPLA5 (rs5764010) C/C и SLCO1B1*1/*5.
Результаты. У пациента удалось уточнить причины возникших биохимических отклонений как при подборе лекарственного препарата для таргетной терапии муковисцидоза, так и при использовании и переключении таргетов. Клинически не значимые отклонения в биохимических показателях функции печени не сопровождались клиническими симптомами.
Выводы. Современные возможности фармакогенетического тестирования позволили выявить у пациента потенциально «проблемное» сочетание генотипов CYP3A *3/*3 и SLCO1B1 *1/*5, ассоциированное с изменением метаболизма лекарственного препарата в печени, поэтому использование фармакогенетического тестирования у пациентов с генетическими заболеваниями открывает перспективы для персонализации и улучшения безопасности фармакотерапии, позволяя предотвратить или отсрочить органные дисфункции для улучшения качества жизни и переносимости терапии препаратами регулярного применения.
Что уже известно об этой теме?
Определение и причины: диссекция позвоночной артерии (ДПА) — это расслоение стенки артерии с образованием интрамуральной гематомы. Она может быть спонтанной или травматической.
Риск инсульта: ДПА является значимой причиной ишемического инсульта, особенно у молодых людей. Инсульт может развиться как сразу, так и отсрочено.
Механизмы инсульта: основные механизмы — артерио-артериальная эмболия и прогрессирование тромбоза в просвете поврежденной артерии.
Стандартное лечение: основой консервативной терапии и вторичной профилактики инсульта является двойная антиагрегантная терапия (ацетилсалициловая кислота + клопидогрел).
Проблема резистентности: известно, что существует генетическая резистентность к клопидогрелу, связанная с полиморфизмами гена CYP2C19, которая снижает его эффективность.
Что нового даёт статья?
Уникальный клинический случай: впервые представлено подробное описание связи между подтвержденной генетической резистентностью к клопидогрелу и развитием отсроченного ишемического инсульта именно у пациента с ДПА, несмотря на стандартную терапию.
Доказательство эффективности коррекции терапии: на практическом примере показано, что замена клопидогрела на прасугрел (который меньше подвержен влиянию генетической резистентности) у такого пациента является безопасной и эффективной тактикой, приведшей к стабилизации состояния и регрессу симптомов.
Актуализация проблемы для ДПА: статья подчеркивает, что проблема генетической резистентности к антиагрегантам при ДПА изучена недостаточно и требует большего внимания.
Как это может повлиять на клиническую практику в обозримом будущем?
Изменение подхода к пациентам с "прорывными" инсультами: развитие инсульта у пациента с ДПА на фоне стандартной антиагрегантной терапии может стать основанием для тестирования на генетическую резистентность к клопидогрелу.
Индивидуализация терапии: в случае выявления резистентности, практика может сместиться в сторону ранней замены клопидогрела на альтернативные препараты (прасугрел, тикагрелор), что позволит предотвратить повторные сосудистые события.
Стимулирование исследований: статья указывает на необходимость поиска простых и доступных лабораторных маркеров (например, в рамках тромбоэластометрии), которые помогли бы быстро выявлять пациентов с ДПА, потенциально не отвечающих на клопидогрел, без сложного генетического тестирования.
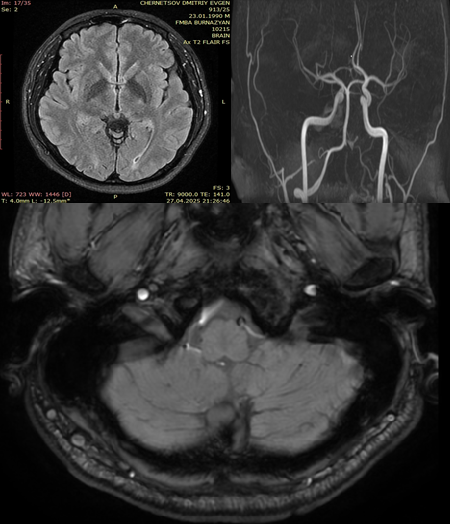
Представлен клинический случай мужчины 35 лет, с диссекцией левой позвоночной артерии, в связи с чем была назначена двойная антиагрегантная терапия в виде ацетилсалициловой кислоты и клопидогрела, а также антикоагулянтная терапия эноксапарином в качестве профилактики развития тромбоэмболических осложнений. На 5 сутки у пациента появилось онемение в правых конечностях, дисфагия и дизартрия, наросла атаксия, полуптоз слева, правосторонние гемипарез и гемигипестезия. При контрольном МРТ-исследовании головного мозга выявлен очаг ишемии в продолговатом мозге. Проведено фармакогенетическое тестирование с исследованием генетической резистентности к антиагрегантным препаратам с определением полиморфных вариантов rs4244285*2, rs4986893*3, rs12248560*17 гена CYP2C19. Было выявлено, что пациент являлся носителем генотипа CT по полиморфному варианту rs12248560, генотипа GA по полиморфному варианту rs4244285, генотипа GG по полиморфному варианту rs4986893 гена CYP2C19. Это соответствует варианту промежуточного метаболизатора с нечётко определённым эффектом клопидогрела. Приведённое клиническое наблюдение с развитием отсроченного ишемического инсульта после диссекции позвоночной артерии (ДПА) привлекает внимание к проблеме генетической резистентности к антиагрегантам в этой популяции пациентов. Развитие отсроченного ишемического инсульта при ДПА является основанием для определения генетической резистентности к антиагрегантам и последующему возможному изменению лечебной тактики.
ISSN 2686-8849 (Online)