Перейти к:
Фармакогенетические маркеры в лечении больных туберкулёзом с множественной лекарственной устойчивостью возбудителя
https://doi.org/10.37489/2588-0527-2025-2-23-29
EDN: UISFIM
Аннотация
Актуальность. Лечение больных туберкулёзом (ТБ) с множественной лекарственной устойчивостью (МЛУ) возбудителя часто осложняется нежелательными реакциями (НР) с вынужденной отменой препаратов, его эффективность далека от целевых показателей и зависит от ряда факторов, в том числе генетических особенностей пациента. Фармакогенетические маркеры МЛУ-ТБ не изучены; ожидается, что их выявление позволит улучшить результаты лечения на основе персонализированного подхода.
Цель. Определить фармакогенетические маркеры, связанные с эффективностью и безопасностью лечения больных туберкулёзом с МЛУ возбудителя.
Методы. В проспективное когортное исследование включено 40 пациентов больных с МЛУ-туберкулёзом без ВИЧ-инфекции, получавших терапию по режимам с включением бедаквилина, линезолида и фторхинолона в 2023–2024 гг. У всех пациентов однократно независимо от сроков терапии осуществляли забор 3–5 мл венозной крови; методом ПЦР в реальном времени определяли наличие однонуклеотидных полиморфизмов генов цитохромов (CYP3A4, CYP3A5), Р-гликопротеина (ABCB1), мембранного АТФ-связывающего кассетного транспортёра (ABCG2), транспортёра органических анионов (SLCO1B1), отобранных на основе анализа литературы и базы PharmGKB. Оценивали их взаимосвязь с показателями эффективности и безопасности лечения с помощью одномерного анализа, с расчётом отношения шансов (ОШ) и его 95 % доверительного интервала (95 % ДИ).
Результаты исследования. Определены целевые полиморфизмы: SLCO1B1 (rs4149056 — у 25,8 %), ABCB1 (rs1045642 — у 75,0 %, rs2032582 — 72,2 %, rs1128503 — 77,8 %), ABCG2 (rs2231142 — у 24,3 %), CYP3A4 (rs2740574 — у 8,1 %), CYP3A5 (rs776746 — у 10,8 %). Эффективность лечения по критерию прекращения бактериовыделения составила 89,3 % (95 % ДИ 72,0–97,1 %); частота НР — 70 % (95 % ДИ 54,5–82,0 %), преобладали нейротоксические реакции (у 11 из 40 больных, 27,5 %). Генотипы АА гена CYP3A5 rs776746 и АА гена ABCG2 rs2231142 ассоциировались с минимальной частотой прекращения бактериовыделения: соответственно, у 33 % и 0 % лиц с каждым вариантом по сравнению со 100 % у остальных, р < 0,01; ОШ 0,021 (95 % ДИ 0,001–0,77) и 0,083 (95 % ДИ 0,01–0,98). Риск нейротоксических реакций был выше при наличии «дикого» варианта (генотип GG) гена ABCB1 rs2032582 (55,6 % против 16,0 % у больных с аллельными полиморфизмами, р = 0,034; ОШ 6,3; 95 % ДИ 1,2–33,3); гастроинтестинальных реакций — при наличии генотипа ТТ гена ABCB1 rs1128503 (50,0 % против 10,0 %, р = 0,045; ОШ = 9,0; 95 % ДИ 1,22–66,2 %).
Заключение. Выявлены полиморфизмы генов CYP3A5 (rs776746, генотип АА) и ABCG2 (rs2231142, генотип АА), связанные с неблагоприятными результатами лечения больных МЛУ-ТБ. Определены генетические предикторы нейротоксических и гастроинтестинальных реакций при лечении больных с МЛУ возбудителя.
Ключевые слова
Для цитирования:
Иванова Д.А., Юровская Е.И., Галкина К.Ю. Фармакогенетические маркеры в лечении больных туберкулёзом с множественной лекарственной устойчивостью возбудителя. Фармакогенетика и фармакогеномика. 2025;(2):23-29. https://doi.org/10.37489/2588-0527-2025-2-23-29. EDN: UISFIM
For citation:
Ivanova D.A., Yurovskaya E.I., Galkina K.Yu. Pharmacogenetic markers in the treatment of patients with multidrug-resistant tuberculosis. Pharmacogenetics and Pharmacogenomics. 2025;(2):23-29. (In Russ.) https://doi.org/10.37489/2588-0527-2025-2-23-29. EDN: UISFIM
Введение
Несмотря на значительное улучшение эпидемиологической ситуации по туберкулёзу в мире и Российской Федерации, актуальным остаётся вопрос лечения больных туберкулёзом (ТБ) с множественной и широкой лекарственной устойчивостью возбудителя. Показатель эффективности лечения по-прежнему далёк от целевых значений: по данным ВОЗ, для российских больных с преширокой и широкой лекарственной устойчивостью (пре-ШЛУ/ШЛУ) в 2024 году он составил 54 % (при целевом уровне 80 %) [1]. Этот «разрыв» требует масштабных усилий по преодолению проблемы, и одним из направлений является разработка персонализированных стратегий ведения больных с учётом индивидуальных особенностей ответа на лечение [2, 3].
Предполагается, что фармакологический ответ на лечение в равных долях зависит от фенотипических (пол, возраст, масса тела, раса, характер туберкулёзного процесса, особенности питания, сопутствующие заболевания, иммунная дисфункция, межлекарственные взаимодействия) и от генетических факторов, определяющих активность ферментов и транспортёров, участвующих в биотрансформации противотуберкулёзных препаратов, медиаторов иммунного ответа. Выявление этих факторов (полиморфизмов в соответствующих генах) наряду с учётом фенотипических особенностей позволит подобрать оптимальные для пациента схемы и дозировки противотуберкулёзных препаратов (ПТП), улучшив результат лечения при минимальном риске токсических эффектов [4–7].
Состав современных режимов лечения туберкулёза резко отличается в зависимости от наличия МЛУ возбудителя. И если для лекарственно-чувствительного туберкулёза известен целый ряд потенциальных фармакогенетических маркеров [8–11], в клинической практике используется оценка типа ацетилирования (генотипа N-ацетилтрансферазы 2, ключевого участника метаболизма изониазида), то в отношении пациентов с МЛУ/ШЛУ возбудителя биомаркеры не изучены, персонализированная стратегия не разработана.
При поиске генетических полиморфизмов — кандидатов на роль фармакогенетического биомаркера — необходимо учитывать следующие условия: 1) участие кодируемого белка в фармакокинетике препарата (-ов); 2) связь между наличием полиморфизма и клиническим эффектом, риском нежелательных реакций (НР); 3) частота встречаемости в популяции (не менее 1 %); 4) возможность использования для коррекции дозы [5].
В «ядро» современных режимов химиотерапии МЛУ/ШЛУ туберкулёза входят так называемые препараты группы А — бедаквилин, линезолид, лево- или моксифлоксацин; коррекция дозы в первую очередь оправдана для линезолида и фторхинолонов. В метаболизме и выведении этих препаратов участвует целый ряд ферментов и транспортёров. Ключевыми из них являются изоформы цитохрома CYP3A4 и СYP3A5, которые участвуют в метаболизме линезолида и бедаквилина, и три основных белка транспортёра [12–14]: Р-гликопротеин, АТФ-связывающий кассетный транспортёр G2 и транспортёр органических анионов OATP B1 (ген SLCO1B1). Для каждого из этих белков известны кодирующие гены, мутации в которых могут быть связаны с изменением фармакологического ответа. Возможности использования этих сведений в практике врача-фтизиатра для прогнозирования и управления ответом на лечение остаются неизвестными.
Цель исследования: определить фармакогенетические маркеры, связанные с эффективностью и безопасностью лечения больных туберкулёзом с МЛУ возбудителя.
Методы
В проспективное когортное исследование включены 40 пациентов больных с МЛУ-, пре-ШЛУ-, ШЛУ-туберкулёзом без ВИЧ-инфекции, зарегистрированных на курс лечения с включением линезолида, фторхинолона и бедаквилина в 2023–2024 гг. в стационарах Государственного бюджетного учреждения здравоохранения «Московский городской научно-практический центр борьбы с туберкулёзом Департамента здравоохранения города Москвы», 24 мужчины (60,0 %) и 16 женщин (40,0 %) в возрасте 19–66 лет (медиана 42 года, интерквартильный размах (ИКР) 32,2–48,0 лет). У 24 больных (60 %) ТБ выявлен впервые. Среди клинических форм преобладал инфильтративный ТБ (57,5 %); доля пациентов с диссеминированным ТБ составила 17,5 %, туберкулёмой лёгкого — 15 %, фиброзно-кавернозным ТБ и казеозной пневмонией — по 5 % (по 2 человека). Полости деструкции в лёгких определены у 29 больных (72,5 %), бактериовыделение на момент старта химиотерапии — у 28 чел. (70 %), при этом МЛУ возбудителя микробиологическими и молекулярно-генетическими методами определена у 23 (73 %) пациентов, пре-ШЛУ — у 7 (17 %), ШЛУ — у 4 человек (10 %). Сопутствующие заболевания имели место у 35 из 40 пациентов (87,5 %), преобладала патология центральной нервной системы (в виде энцефалопатии разного генеза, у 17 чел., 42,5 %), желудочно-кишечного тракта (32,5 %), опорно-двигательного аппарата (30 %), сердечно-сосудистой системы (25 %).
Режим химиотерапии формировали согласно актуальной версии клинических рекомендаций («Туберкулёз у взрослых» [15]) с учётом индивидуального спектра лекарственной чувствительности возбудителя, анамнестических данных о переносимости терапии, спектра и тяжести сопутствующей патологии; все пациенты в составе схемы лечения получали бедаквилин, линезолид и фторхинолоны (моксифлоксацин, или левофлоксацин, или спарфлоксацин), а также другие препараты, рекомендуемые в составе режима (циклосерин или теризидон, деламанид, протионамид, ПАСК, амикацин или капреомицин, карбапенемы). Спектр назначаемых ПТП представлен на рис. 1.
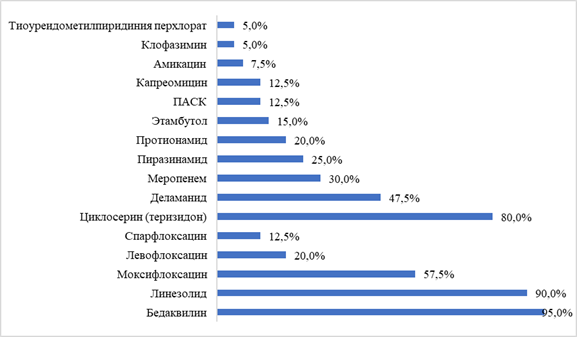
Рис. 1. Частота назначения различных противотуберкулёзных препаратов у 40 больных туберкулёзом органов дыхания (указана доля больных в %, получавших каждый препарат)
На основе анализа литературы и данных онлайн-базы знаний PharmGKB (https://www.pharmgkb.org/) определены однонуклеотидные полиморфизмы (single nucleotide polymorphisms, SNP) в генах CYP3A4, CYP3A5, ABCB1, SLCO1B1, ABCG2, связанные с фармакокинетикой основных ПТП для лечения МЛУ-туберкулёза (см. табл. 1), и доступные для тестирования методом полимеразной цепной реакции в реальном времени (ПЦР-РВ).
У всех пациентов однократно, независимо от сроков терапии осуществляли забор 3–5 мл венозной крови для фармакогенетического исследования. Методом ПЦР-РВ с использованием наборов производства ООО «НПФ Синтол» (Россия) определяли наличие целевых SNP генов белков-транспортёров: SLCO1B1 (rs4149056 или Т521С), ABCB1 (rs1045642 или C3435T, rs2032582 или G2677T, rs1128503 или C1236T), ABCG2 (rs2231142, C421A), а также ферментов семейства цитохрома CYP3A: CYP3A4 (rs2740574, A/G), CYP3A5 (rs776746, G/A). Срок наблюдения каждого пациента составлял не менее 6 месяцев (у 38 из 40 пациентов соответствовал длительности интенсивной фазы лечения).
Эффективность лечения оценивали по срокам прекращения бактериовыделения, наличию положительной клинико-рентгенологической динамики (закрытия полости распада); безопасность — по данным о частоте и спектре нежелательных реакций, наличие реакций 3–4 степени тяжести по критериям NCI Common Terminology Criteria for Adverse Events (CTCAE) версии 5.0 (2017) [16]. Причинно-следственную связь реакции с приёмом определённого препарата в составе режима оценивали с помощью шкалы Наранжо и экспертной оценки. Определяли взаимосвязь показателей эффективности и безопасности с наличием и вариантом исследуемых SNP на основе одномерного анализа, с использованием критерия χ2, точного критерия Фишера, расчёта отношения шансов (ОШ) и его 95 % доверительного интервала (95 % ДИ). Статистическую обработку данных проводили в среде IBM SPSS Statistics, версия 25.0.
Результаты
Интенсивная фаза лечения была успешно завершена с констатацией эффективности проводимой терапии у 37 из 40 пациентов (92,5 %) в сроки 6–9 месяцев; один пациент из трёх оставшихся умер от прогрессирования туберкулёзного процесса, двое продолжают лечение с коррекцией схемы и пролонгированием интенсивной фазы. Прекращение бактериовыделения отмечено у 25 из 28 больных — бактериовыделителей (89,3 %; 95 % ДИ 72,0–97,1 %) на сроках от 4 до 36 недель от начала химиотерапии (медиана 4 недели, ИКР 4–8 недель); полости распада закрылись у 23 из 29 пациентов (79,3 %; 95 % ДИ 61,3–90,5 %).
Нежелательные реакции зарегистрированы у 36 пациентов (70 %; 95 % ДИ 54,5–82,0 %), из них у 62,5 % больных (95 % ДИ 47,0–75,8 %) развились НР 3–4 степени тяжести, требующие отмены как минимум одного ПТП и коррекции схемы лечения. Всего зарегистрировано 50 случаев НР, от одной до шести на одного пациента. Спектр НР представлен на рис. 2.
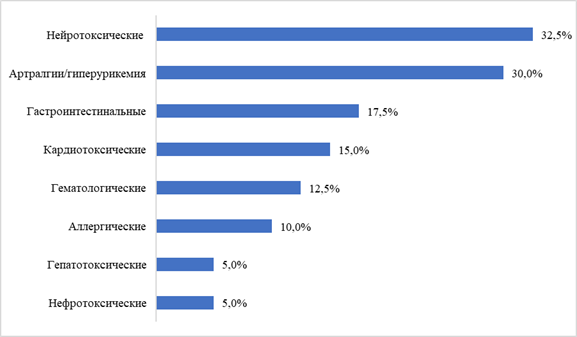
Рис. 2. Спектр нежелательных побочных реакций (указано доля пациентов в % с развившимися реакциями)
Преобладали нейротоксические (у 13 чел., 32,5 %, преимущественно в виде периферической нейропатии) и гастроинтестинальные реакции (у 7 чел., 17,5 %), артралгии (у 12 чел., 30 %). В равной степени отмечали развитие гематологических и аллергических (по 4 случая, 10 %), а также нефро- и гепатотоксических реакций (по 2 пациента, 5 %). Клинически значимое удлинение интервала QTс (более 500 мсек) отмечено у 4 пациентов (10 %).
Результаты фармакогенетического тестирования (частота выявления различных вариантов исследуемых полиморфизмов) представлены в табл. 1.
Таблица 1. Частота выявления генетических полиморфизмов в исследуемой группе (40 больных туберкулёзом)
Доля больных с разными вариантами генотипа | OATP 1B1 rs4149056 (T521C) | ABCB1 rs1045642 (C3435T) | ABCB1 rs2032582 (G2677T) | ABCB1 rs1128503 (C1236T) | ABCG2 rs2231142 (C421A) | CYP3A4 rs2740574 (A/G) | CYP3A5 rs776746 (G/A) |
Наличие минимум одного мутантного аллеля | 25,8 % | 75,0 % | 72,2 % | 77,8 % | 24,3 % | 8,1 % | 10,8 % |
Гетерозигота (1 аллель с полиморфизмом) | 6,5 % | 58,3 % | 52,8 % | 61,1 % | 13,5 % | 5,4 % | 0,0 % |
Гомозигота (оба аллеля с полиморфизмом) | 19,4 % | 16,7 % | 19,4 % | 16,7 % | 10,8 % | 2,7 % | 10,8 % |
Гомозигота ("дикий") тип | 74,2 % | 25,0 % | 27,8 % | 22,2 % | 78,4 % | 91,9 % | 89,2 % |
Установлено, что частота выявления исследуемых аллельных полиморфизмов варьировала от 8,1 % (для гена CYP3A4) до 77,8 % (для полиморфизма rs1128503 в гене Р-гликопротеина). Генотипы с мутацией в обеих аллелях гена (гомозиготной) встречались редко (2,7–19,4 %); предполагалось, что в этом случае фенотип соответствует наиболее значительному нарушению функции кодируемого белка.
Выявлена взаимосвязь показателей эффективности лечения с двумя фармакогенетическими маркерами: наличием гомозиготных полиморфизмов в генах цитохрома CYP3A5 (rs776746) и АТФ-связывающего кассетного транспортёра G2 (rs2231142).
Так, прекращение бактериовыделения зарегистрировано только у одного из трёх пациентов-бактериовыделителей с генотипом АА гена CYP3A5 rs776746 (33 %) против 100 % конверсии мокроты у 25 больных с «немутантным» вариантом генотипа (GG), р <0,01, ОШ=0,021 (95 % ДИ 0,001–0,77).
Ни у одного из пациентов, имеющих гомозиготную мутацию гена ABCG2 (rs2231142, генотип АА), не было достигнуто прекращение бактериовыделения в стандартные сроки интенсивной фазы химиотерапии (у одной пациентки бактериовыделение прекратилось после 9 месяцев лечения), в то время как у больных с генотипами AG и GG успешный исход лечения по микробиологическому критерию достигнут в 100 % случаев, р <0,01, ОШ=0,083 (95 % ДИ 0,01–0,98). Генотип АА гена ABCG2 rs2231142 был также связан с низкой частотой закрытия полости распада: 25 % против 75 % у пациентов с генотипами AG и GG, р <0,01, ОШ=0,083, 95 % ДИ 0,01–0,98 (рис. 3).
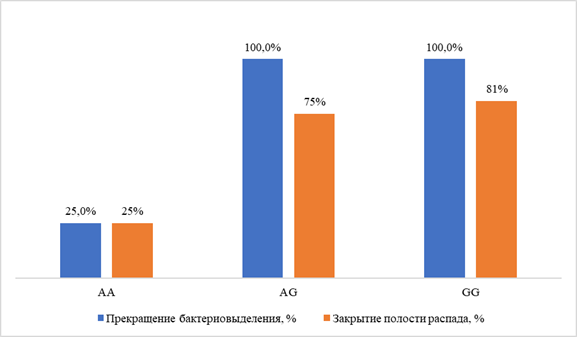
Рис. 3. Показатели эффективности лечения у больных с разными вариантами генотипа ABCG2 rs2231142
Ни один из исследуемых полиморфизмов не продемонстрировал статистически значимой взаимосвязи с общей частотой НР. При анализе возможных маркеров для отдельных типов реакций определена более высокая частота нейротоксических реакций у пациентов с генотипом GG («диким») гена ABCB1 rs2032582 (55,6 против 16,0 %) у больных с генотипами AG и AA, р=0,034, ОШ 6,3 (95 % ДИ 1,2–33,3). Фактором риска для гастроинтестинальных реакций служило наличие генотипа ТТ (гомозиготной мутации) в гене ABCB1 rs1128503 (50,0 против 10,0 %) у больных с генотипами CT и СС, р=0,045, ОШ=9,0 (95 % ДИ 1,22–66,2 %).
Кроме того, наблюдали тенденцию повышения риска гематологических реакций (анемии, лейкопении, тромбоцитопении) при наличии генотипа ТТ гена ABCB1 rs1045642 (33,3 % у больных с гомозиготным полиморфизмом против 3,3 % у больных с генотипами CC и CT); различия были статистически незначимыми — р=0,06 по критерию χ2, ОШ=14,5 (95 % ДИ 1,06–198,8 %). Наличие полиморфизма rs4149056 (генотипов СС или ТС) гена SLCO1B1, напротив, играло протективную роль: у больных с генотипом ТТ (отсутствием полиморфизма, «диким» вариантом) частота артралгий составила 45,5 %, у при наличии хотя бы одного «мутантного» аллеля случаев артралгии не отмечено (р=0,03 по точному критерию Фишера, ОШ=1,79, 95 % ДИ 1,23–2,56). Таким образом, в генезе НР наибольшее значение имели полиморфизмы генов белков-транспортёров, в частности, Р-гликопротеина.
Обсуждение
Проведённое исследование является поисковым в отношении комплекса фармакогенетических маркеров, применимых для современных режимов лечения больных МЛУ-ТБ. Более ранние единичные работы были посвящены изучению взаимосвязи отдельных полиморфизмов или с фармакокинетикой определённого препарата [13, 14], или с клиническими показателями эффективности и безопасности [17, 18]. В нашем исследовании не подтверждена взаимосвязь эффективности лечения и частоты НР с полиморфизмом CYP3A4 rs2740574, выявленная в работе Захарова А.В. и соавт. [17]; в то же время получены данные о потенциальной пользе ряда других биомаркеров, связанных с фармакокинетикой основных препаратов, которые применяются в современных режимах лечения МЛУ-ТБ. В частности, подтверждена роль полиморфизма CYP3A5, выявленная в работе Юнусбаевой М.М. и соавт. [18]. Главным результатом исследования является выявление генетического предиктора неэффективного лечения — полиморфизма в гене ABCG2 АТФ-связывающего кассетного транспортёра G. Ранее с этим SNP связывали только риск гепатотоксичности [19]. Учитывая полученные данные, обнаружение гомозиготного генотипа (АА) может ориентировать врача на более длительные режимы лечения.
Кроме того, выявлены аллельные полиморфизмы, связанные с риском значимых побочных реакций (для генов Р-гликопротеина и транспортёра органических анионов В1). Таким образом, определён возможный состав фармакогенетической панели, применимой для прогнозирования ответа на лечение и выработки оптимальной лечебной стратегии у наиболее сложной категории пациентов.
Данное исследование имеет ряд ограничений, связанных с его «пилотным», поисковым характером: в первую очередь, относительно малый объём выборки, во вторую, отсутствие анализа фенотипических факторов с потенциальным влиянием на исход лечения. Планируется продолжение работы с использованием большего объёма выборки, изучением прогностического значения полиморфизмов других ферментов и транспортёров, ассоциированных с эффективностью и безопасностью лечения больных туберкулёзом с МЛУ/ШЛУ возбудителя.
Заключение
Выявлены полиморфизмы генов CYP3A5 (rs776746, генотип АА) и ABCG2 (rs2231142, генотип АА), связанные с неблагоприятными результатами лечения больных МЛУ-ТБ. Определены генетические предикторы нейротоксических и гастроинтестинальных реакций при лечении больных с МЛУ возбудителя.
Полученные результаты применимы для выявления пациентов, нуждающихся в формировании индивидуализированных режимов лечения с целью подбора наиболее эффективной лечебной тактики, а также для ранней профилактики НР соответствующего типа.
Список литературы
1. WHO. Global Tuberculosis Report 2024. – Geneva: World Health Organization, 2024. – P. 1-68. URL: https://worldhealthorg.shinyapps.io/tb_profiles/
2. Guglielmetti L, Panda S, Abubakirov A, et al. Equitable, personalised medicine for tuberculosis: treating patients, not diseases. Lancet Respir Med. 2025 May;13(5):382-385. doi: 10.1016/S2213-2600(25)00080-3.
3. Thu VTA, Dat LD, Jayanti RP, et al. Advancing personalized medicine for tuberculosis through the application of immune profiling. Front Cell Infect Microbiol. 2023 Feb 10;13:1108155. doi: 10.3389/fcimb.2023.1108155.
4. Клиническая фармакогенетика: учебное. пособие для студентов медицинских вузов / Д. А. Сычев [и др.]; под. ред. В. Г. Кукеса, Н. П. Бочкова. Москва: ГЭОТАР-Медиа, 2007. 245 с. ISBN 978-5-9704-0458-4.
5. Можокина Г.Н., Казаков А.В., Елистратова Н.А., Попов С.А. Ферменты биотрансформации ксенобиотиков и персонификация режимов лечения больных туберкулезом. Туберкулёз и болезни лёгких. 2016;94(4):6-12. doi: 10.21292/2075-1230-2016-94-4-6-12.
6. Verma R, da Silva KE, Rockwood N, Wasmann RE, Yende N, Song T, Kim E, Denti P, Wilkinson RJ, Andrews JR. A Nanopore sequencing-based pharmacogenomic panel to personalize tuberculosis drug dosing. medRxiv. Am J Respir Crit Care Med. 2024 Jun 15;209(12):1486-1496. doi: 10.1164/rccm.202309-1583OC.
7. Кантемирова Б.И., Галимзянов Х.М., Степанова Н.А., и др. Перспективы фармакогенетического тестирования для разработки алгоритмов персонализированного лечения тубекулёза органов дыхания в Астраханском регионе. Антибиотики и Химиотерапия. 2015;60(910):29-32.
8. Azuma J, Ohno M, Kubota R, et al; Pharmacogenetics-based tuberculosis therapy research group. NAT2 genotype guided regimen reduces isoniazid-induced liver injury and early treatment failure in the 6-month four-drug standard treatment of tuberculosis: a randomized controlled trial for pharmacogenetics-based therapy. Eur J Clin Pharmacol. 2013 May;69(5):1091-101. doi: 10.1007/s00228-012-1429-9.
9. Краснова Н.М., Евдокимова Н.Е., Егорова А.А., и др. Влияние типа ацетилирования на частоту гепатотоксичности изониазида у пациентов с впервые выявленным туберкулезом органов дыхания. Антибиотики и Химиотерапия. 2020;65(7-8):31-36. doi: 10.37489/02352990-2020-65-7-8-31-36.
10. Yang S, Hwang SJ, Park JY, et al. Association of genetic polymorphisms of CYP2E1, NAT2, GST and SLCO1B1 with the risk of anti-tuberculosis drug-induced liver injury: a systematic review and meta-analysis. BMJ Open. 2019;9(8):e027940. doi:10.1136/bmjopen-2018-027940.
11. Иванова Д.А., Галкина К.Ю., Борисов С.Е., и др. Фармакогенетические методы в оценке риска гепатотоксических реакций при лечении впервые выявленных больных туберкулезом. Туберкулез и социально значимые заболевания. 2018;(3):43-48.
12. Проблемы лекарственной устойчивости микобактерий / под ред. Е.М. Богородской, Д.А. Кудлая, В.И. Литвинова. М.: МНПЦБТ. 2021. 504 с. ISBN 978-5-89180-134-9.
13. Haas DW, Abdelwahab MT, van Beek SW, et al. Pharmacogenetics of Between-Individual Variability in Plasma Clearance of Bedaquiline and Clofazimine in South Africa. J Infect Dis. 2022 Aug 12;226(1):147-156. doi: 10.1093/infdis/jiac024.
14. Annisa N, Afifah NN, Santoso P, et al. Pharmacogenetics and Pharmacokinetics of Moxifloxacin in MDR-TB Patients in Indonesia: Analysis for ABCB1 and SLCO1B1. Antibiotics (Basel). 2025 Feb 16;14(2):204. doi: 10.3390/antibiotics14020204.
15. Клинические рекомендации. Туберкулез у взрослых. 2024. Министерство здравоохранения Российской Федерации: официальный сайт. Доступно по: https://cr.minzdrav.gov.ru/recomend/16_3. Ссылка активна на 15.06.2025
16. Common Terminology Criteria for Adverse Events (CTCAE) v5.0. Доступно по: https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm. Дата обращения: Ссылка активна на 15.06.2025
17. Захаров А.В., Еремеев В.В., Чумоватов Н.В., и др. Клиникогенетические ассоциации полиморфных аллелей гена CYP3A4 у больных туберкулезом легких с лекарственной устойчивостью возбудителя. Вестник ЦНИИТ. 2024;8(4):17-30. doi: 10.57014/2587-6678-2024-8-4-17-30.
18. Юнусбаева М.М., Бородина Л.Я., Билалов Ф.С. и др. Исследование влияния полиморфизма генов CYP3A5, CYP2B6 и NAT2 на эффективность лечения туберкулёза с множественной лекарственной устойчивостью. Фармакогенетика и фармакогеномика. 2020;(2):26-27. doi: 10.37489/2588-0527-2020-2-26-27.
19. Wang N, Chen X, Hao Z, et al. Association of ABCG2 polymorphisms with susceptibility to anti-tuberculosis drug-induced hepatotoxicity in the Chinese population. Xenobiotica. 2022 May;52(5):527-533. doi: 10.1080/00498254.2022.2093685.
Об авторах
Д. А. ИвановаРоссия
Иванова Диана Александровна — д. м. н., учёный секретарь, врач-фтизиатр, врач-терапевт Городского клинико-диагностического центра ГБУЗ «МНПЦ борьбы с туберкулёзом ДЗМ»; профессор кафедры фтизиатрии ФГБОУ ДПО РМАНПО Минздрава России.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Е. И. Юровская
Россия
Юровская Екатерина Игоревна— врач-фтизиатр диспансерного фтизиатрического отделения филиала по СЗАО ГБУЗ «МНПЦ борьбы с туберкулёзом ДЗМ»
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
К. Ю. Галкина
Россия
Галкина Ксения Юрьевна — к. б. н., в. н. с. отдела проблем лабораторной диагностики туберкулёза и патоморфологии ГБУЗ «МНПЦ борьбы с туберкулёзом ДЗМ».
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Что уже известно об этой теме?
Проблема лечения: лечение туберкулёза с множественной (МЛУ) и широкой (ШЛУ) лекарственной устойчивостью остается сложной задачей, а его эффективность (54% в РФ) значительно ниже целевых показателей ВОЗ (80%).
Роль фармакогенетики: ответ на терапию зависит как от фенотипических (возраст, сопутствующие болезни и т.д.), так и от генетических факторов, влияющих на метаболизм и транспорт препаратов.
Недостаток данных: в то время как для чувствительного туберкулёза некоторые фармакогенетические маркеры (например, NAT2 для изониазида) известны, для современных режимов лечения МЛУ/ШЛУ-ТБ персонализированные подходы не разработаны, а биомаркеры практически не изучены.
Что нового даёт статья?
Выявлены новые маркеры эффективности: впервые в ходе клинического исследования у пациентов с МЛУ/ШЛУ-ТБ выявлены два конкретных генетических полиморфизма, достоверно связанных с низкой эффективностью лечения:
Гомозиготный генотип AA в гене CYP3A5 (rs776746).
Гомозиготный генотип AA в гене ABCG2 (rs2231142).
Выявлены маркеры безопасности: обнаружены полиморфизмы, ассоциированные с риском развития конкретных нежелательных реакций (НР):
Нейротоксичность: связана с "диким" генотипом GG в гене ABCB1 (rs2032582).
Гастроинтестинальные реакции: связаны с гомозиготным генотипом TT в гене ABCB1 (rs1128503).
Протективный эффект: полиморфизм в гене SLCO1B1 (rs4149056) снижал риск развития артралгий.
Предложен состав фармакогенетической панели: определён конкретный набор генов (CYP3A5, ABCG2, ABCB1, SLCO1B1), анализ которых может быть полезен для прогнозирования исхода лечения.
Как это может повлиять на клиническую практику в обозримом будущем?
Персонализация терапии: в будущем, при подтверждении результатов на более крупных выборках, генетическое тестирование позволит до начала лечения выявлять пациентов с высоким риском неудачи терапии (носителей CYP3A5 AA и ABCG2 AA).
Коррекция лечебной тактики: для таких пациентов можно будет сразу планировать более длительные или усиленные режимы химиотерапии, чтобы повысить шансы на успех.
Профилактика осложнений: выявление пациентов с генетическим риском специфических НР (например, нейротоксичности) позволит проводить направленный мониторинг и своевременно проводить профилактику или коррекцию доз, улучшая переносимость лечения.
Создание алгоритмов: результаты работы закладывают основу для разработки клинических рекомендаций по применению фармакогенетического тестирования у пациентов с МЛУ/ШЛУ-ТБ.
Рецензия
Для цитирования:
Иванова Д.А., Юровская Е.И., Галкина К.Ю. Фармакогенетические маркеры в лечении больных туберкулёзом с множественной лекарственной устойчивостью возбудителя. Фармакогенетика и фармакогеномика. 2025;(2):23-29. https://doi.org/10.37489/2588-0527-2025-2-23-29. EDN: UISFIM
For citation:
Ivanova D.A., Yurovskaya E.I., Galkina K.Yu. Pharmacogenetic markers in the treatment of patients with multidrug-resistant tuberculosis. Pharmacogenetics and Pharmacogenomics. 2025;(2):23-29. (In Russ.) https://doi.org/10.37489/2588-0527-2025-2-23-29. EDN: UISFIM










































