Перейти к:
Фармакогенетическая модель прогнозирования терапевтического ответа на метотрексат у пациентов с ревматоидным артритом
https://doi.org/10.37489/2588-0527-2025-2-30-39
EDN: OEWJGS
Аннотация
Актуальность. Неэффективность метотрексата (МТ) у 30 % пациентов с ревматоидным артритом (РА) и связанные с ним побочные действия ограничивают эффективность лечения, диктуя необходимость разработки инструментов прогнозирования терапевтического ответа [1]. Отсутствие надёжных фармакогенетических моделей сдерживает развитие персонализированного подхода к лечению РА.
Цель. Разработать фармакогенетическую модель прогнозирования риска неответа на МТ у пациентов с РА на основе полиморфизмов генов ключевых белков, участвующих в метаболизме фармпрепарата.
Методы. В проспективное когортное исследование включён 281 пациент с РА. Параметры отбора: подтверждённый диагноз РА по критериям Европейского альянса ассоциаций ревматологов и назначение МТ в качестве стартового базисного противовоспалительного препарата. Через 6 месяцев лечения оценивался терапевтический ответ по индексу активности DAS28 (Disease Activity Score-28), выделены группы «ответчики» — 170 пациентов и «неответчики» — 111 пациентов. Проведено генотипирование полиморфизмов SLC19A1 (rs1051266), ABCB1 (rs1128503, rs2032582), GGH (rs3758149), FPGS (rs4451422, rs1544105), MTHFR (rs1801131, rs1801133), ATIC (rs2372536), ADA (rs244076), AMPD1 (rs17602729), ITPA (rs1127354). Используя методы снижения многофакторной размерности (MDR) и информационного анализа (энтропия Шеннона), разработаны модели прогнозирования эффективности МТ.
Результаты. Итоговая модель прогноза риска неответа на МТ объединяет пять однонуклеотидных полиморфизмов «ATIC rs2372536 + MTHFR rs1801133 + ADA rs244076 + MTHFR rs1801131 + SLC19A1 rs1051266», обеспечивает чувствительность 80,2 %, специфичность 69,4 % (OR 9,18 [95 % ДИ 5,19; 16,22] и обладает высокой устойчивостью в кросс-проверке (10/10).
Заключение. Разработанная пятигенная модель демонстрирует высокую диагностическую эффективность для прогнозирования неответа на МТ при РА. Практическое применение модели реализуется с помощью решающего правила «если, то».
Ключевые слова
Для цитирования:
Девальд И.В., Мысливцова К.Ю., Лила А.М., Ходус Е.А., Хромова Е.Б. Фармакогенетическая модель прогнозирования терапевтического ответа на метотрексат у пациентов с ревматоидным артритом. Фармакогенетика и фармакогеномика. 2025;(2):30-39. https://doi.org/10.37489/2588-0527-2025-2-30-39. EDN: OEWJGS
For citation:
Devald I.V., Myslivtsova K.Yu., Lila A.M., Khodus E.A., Khromova E.B. Pharmacogenetic model for predicting therapeutic response to methotrexate in patients with rheumatoid arthritis. Pharmacogenetics and Pharmacogenomics. 2025;(2):30-39. (In Russ.) https://doi.org/10.37489/2588-0527-2025-2-30-39. EDN: OEWJGS
Введение
Ревматоидный артрит (РА) — хроническое системное аутоиммунное заболевание, характеризующееся симметричным воспалением суставов, прогрессирующей деструкцией хряща и кости, а также возможными внесуставными проявлениями [2]. Лечение РА за последние десятилетия претерпело значительные изменения как терапевтических целей, так и стратегий. В последние годы активно обсуждаются перспективы достижения безмедикаментозной ремиссии, а также использование генно-инженерных биологических препаратов и ингибиторов Янус-киназ [3]. Несмотря на это, метотрексат (МТ) остаётся основным базисным противовоспалительным препаратом (БПВП) для терапии РА [4]. Его широкое применение обусловлено не только клинической эффективностью, но и экономической целесообразностью.
МТ рекомендован ведущими международными ревматологическими ассоциациями, как препарат первой линии для монотерапии или в комбинации с другими БПВП [4, 5]. Однако эффективность МТ ограничена у 30 % пациентов из-за недостаточного терапевтического ответа или побочных эффектов, требующих отмены препарата [1]. Отсутствие инструментов для предсказания ответа на терапию остаётся значимой проблемой.
Ключевым аспектом стратегии «лечение до достижения цели» (treat-to-target) является раннее начало терапии БПВП, особенно в первые шесть месяцев от дебюта РА, что значительно повышает вероятность длительной ремиссии заболевания. В связи с этим крайне важна ранняя идентификация факторов риска терапевтической неэффективности МТ. Ведётся активный поиск клинических, лабораторных и генетических маркеров, способных предсказать реакцию на МТ. Среди них обсуждаются демографические характеристики, такие как пол и возраст, а также курение, вес, иммунологические показатели и др. [6–9]. Изучаются однонуклеотидные полиморфизмы (single nucleotide polymorphisms, SNP) генов, кодирующие одноимённые белки, участвующие в фармакокинетике и фармакодинамике МТ (рис. 1). Настоящее исследование направлено на разработку фармакогенетической модели прогнозирования ответа на МТ при РА. Создание прогностических моделей и их практическое применение используется в онкологии, психиатрии и других сферах медицинской практики. В клинической ревматологии, включая терапию самого распространённого аутоиммунного заболевания, РА, подобное направление не нашло отражения. Одним из главных ограничений для реализации фармакогенетических исследований является отсутствие лабораторных тестов для типирования полиморфизмов.

Рис. 1. Механизм действия метотрексата, адаптировано из [10]
Примечание: Красным выделены белки, одноименные гены которых изучены в текущем исследовании.
МТ (methotrexate) — метотрексат; SLC19A1 (solute carrier family 19 member 1) — транспортер фолатов и МТ в клетку; ABCB1 (ATP Binding Cassette Subfamily B Member 1) — транспортер Р-гликопротеин, который выводит МТ из клетки; FPGS (folylpolyglutamate synthase) — фолилполиглютаматсинтаза; GGH (gamma-glutamyl hydrolase) — гаммаглютамилгидролаза; МТPG — полиглютамированный МТ; DHFR (dihydrofolate reductase) — дегидрофолатредуктаза; THF (tetrahydrofolate) — тетрагидрофолат; 5,10-СН2-THF (5,10-methylentetrahydrofolate) — 5,10-метилентетрагидрофолат; MTHFR (methylenetetrahydrofolate reductase) — метилентетрагидрофолатредуктаза; 5-СН3-THF (5-methyltetrahydrofolate) — 5-метилтетрагидрофолат; DHF (dihydrofolate) — дигидрофолат; MS (methionine synthase) — метионинсинтаза; TS (thymidylate synthase) — тимидилатсинтаза; dUMP (deoxyuridine monophosphate) — дезоксиуридинмонофосфат; dTMP (deoxythymidine monophosphate) — дезокситимидимонофосфат; ATIC (5-aminoimidazole-4-carboxamide ribonucleotide transformylase) — 5-аминоимидазол-4-карбоксамид рибонуклеотид трансформилаза; 10-CHO-THF (methylenetetrahydrofolate dehydrogenase) — метилентетрагидрофолатдегидрогеназа; AICAR (5-aminoimidazole-4-carboxamide ribonucleotide) — 5-аминоимидазол-4-карбоксамид рибонуклеотид; FAICAR (5-formylaminoimidazole-4-carboxamide ribonucleotide) — 5-формиламиноимидазол-4-карбоксамид рибонуклеотид; ITPA (inosine triphosphatase) — инозинтрифосфатаза; ITP (inosine triphosphate) — инозинтрифосфат; IMP (inosine monophosphate) — инозинмонофосфат; ATP (adenosine trihosphate) — аденозинтрифосфат; AMP (adenosine monophosphate) — аденозинмонофосфат; AMPD1 (adenosine monophosphate deaminase) — аденозинмонофосфат-деаминаза 1; ADA (adenosine deaminase) — аденозиндеаминаза; cAMP (cyclic adenosine monophosphate) — циклический аденозинмонофосфат; IL-10 (interleukin-10) — интерлейкин-10.
Материалы и методы
Исследование получило одобрение локального этического комитета Челябинской государственной медицинской академии Министерства здравоохранения Российской Федерации (протокол №10 от 25 ноября 2012 года).
В исследование вошли 281 пациент с подтверждённым диагнозом РА. Исследование выполнено в формате проспективной когортной модели с набором участников на протяжении десятилетнего периода. Через шесть месяцев лечения МТ оценивалась эффективность терапии по индексу активности DAS28 (Disease Activity Score-28), выделены группы «ответчиков» — 170 пациентов и «неответчиков» 111 пациент. Использовав кандидатный подход, выделены 12 SNP девяти генов, участвующих в метаболизме МТ. SNP отобраны на основе следующих критериев: все зарегистрированы в базе данных dbSNP и имеют подтверждённые ассоциации с эффективностью МТ, опубликованные в PubMed или PharmGKB. Частота минорного аллеля каждого SNP в популяции составляла не менее 5 %, обеспечивая статистическую релевантность.
Геномную ДНК экстрагировали из образцов периферической венозной крови с использованием коммерческого набора «Protrans DNA Box 500» (Германия). Генотипирование осуществляли методом полимеразной цепной реакции (ПЦР). Для 10 полиморфизмов: SLC19A1 SNP rs1051266 (G80A); ABCB1 SNP rs1128503 (C1236T) и rs2032582 (A2677C); GGH SNP rs3758149 (C-401T); FPGS SNP rs84451422 (A>C) и rs1544105 (C105T); ATIC SNP rs2372536 (C347G); ADA SNP rs244076 (T>C); AMPD1 SNP rs17602729 (C34T); ITPA SNP rs1127354 (C94A) впервые были разработаны праймеры отечественного производства ООО «ТестГен» (Россия), для полиморфизмов MTHFR SNP rs1801131 (A1298C) и rs1801133 (C677T) использованы готовые праймеры. Детекцию продуктов амплификации проводили в режиме FLASH-анализа по конечной точке, работу выполняли на амплификаторах QuantStudio (Applied Biosystems). Интерпретацию данных проводили с использованием программного обеспечения QuantStudio Design and Analysis Software (версия 1.5.2).
Статистическая обработка данных проводилась с использованием метода многофакторного снижения размерности (MDR) и информационного анализа (энтропия Шеннона), в результате получено несколько прогностических моделей эффективности МТ.
Результаты
Разработка прогностических моделей требует тщательного выбора показателей, обеспечивающих высокую точность и минимальное количество переменных. Надёжность модели подразумевает её способность точно предсказывать результаты как на исследуемой выборке, так и на других данных из генеральной совокупности. Оптимальность достигается за счёт использования наименьшего числа предикторов, сохраняющих высокую предсказательную способность. Для выявления генов и их взаимодействий, влияющих на риск отсутствия ответа на МТ у пациентов с РА, применялась методика MDR. Процесс создания прогностической модели включал несколько этапов.
Автоматический анализ — начальный этап поиска оптимальных фармакогенетических моделей, охватывающий от одного до трёх генов (табл. 1, рис. 2, рис. 3).
Таблица 1. Модели автоматического построения прогноза неответа на терапию по результатам MDR-анализа (nнеответ=111, nответ=170)
Модель | Чувствительность, % [95 % ДИ] Специфичность, % [95 % ДИ] Диагностическая эффективность | OR [95 % ДИ] | P | Надёжность модели в кросс-проверке |
ATIC rs2372536 | 57,7 [48,4; 66,6] 58,8 [51,3; 66,0] 58,2 | 1,95 [1,20; 3,16] | χ2(1)=7,31 р = 0,007 | 10 /10 |
ATIC rs2372536 + SLC19A1 rs1051266 | 65,8 [56,6; 74,1] 55,3 [47,8; 62,6] 60,5 | 2,38 [1,45; 3,90] | χ2(1)=11,96 р <0,001 | 6 /10 |
ATIC rs2372536 + SLC19A1 rs1051266 + MTHFR rs1801133 | 73,0 [64,2; 80,6] 58,2 [50,7; 65,5] 65,6 | 3,76 [2,24; 6,32] | χ2(1)=26,34 р <0,001 | 5 /10 |
Отдельные двухгенные модели | ||||
ATIC rs2372536 + MTHFR rs1801133 | 59,5 [50,2; 68,3] 59,4 [51,9; 66,6] 59,4 | 2,15 [1,32; 3,49] | χ2(1)=9,58 р=0,002 | 10 /10 |
ADA rs244076 + MTHFR rs1801131 | 53,2 [43,9; 62,3] 57,7 [48,4; 66,6] 55,4 | 1,54 [0,95; 2,50] | χ2(1)= 3,15 р=0,076 | 10 /10 |
SLC19A1 rs1051266 + FPGS rs4451422 | 45,0 [36,0; 54,3] 72,9 [65,9; 79,2] 59,0 | 2,21 [1,33; 3,66] | χ2(1)=9,66 р=0,002 | 10 /10 |
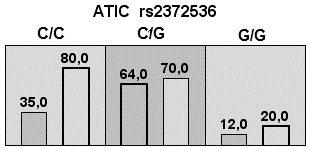
Наибольшую прогностическую значимость в качестве одногенной модели, показал полиморфизм ATIC rs2372536, демонстрирующий чувствительность 57,7 % (95 % ДИ: 48,4;66,6), специфичность 58,8 % (95 % ДИ: 51,3;66,0), диагностическую эффективность 58,2 % и полную устойчивость при десятикратной кросс-валидации (10/10) (табл. 1, рис. 2А).
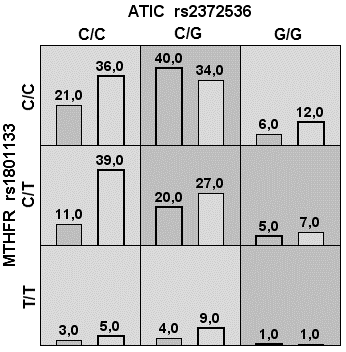
Следующая автоматически сгенерированная модель, включала комбинацию «ATIC rs2372536 + SLC19A1 rs1051266». Эта ассоциация продемонстрировала умеренное улучшение диагностической точности с чувствительностью 65,8 %, однако низкую устойчивость при кросс-валидации (6/10), что ограничивает её применимость для других выборок (табл. 1, рис. 2В). Добавление MTHFR rs1801133 повысило чувствительность до 73,0 % и отношение шансов до 3,76. Однако устойчивость модели «ATIC rs2372536 + SLC19A1 rs1051266 + MTHFR rs1801133» при кросс-проверке низкая 5/10, что снижает её надёжность для практического применения (табл. 1, рис. 2С).
|
|
А | В |
 | |
C | |
Рис. 2. Столбчатые диаграммы числа пациентов в ячейках сочетания генотипов для трёх (А, В и С) моделей автоматического построения
Примечания: Столбцы слева — количество неответчиков, столбцы справа — число ответчиков на терапию; тёмно-серые ячейки — комбинации повышенного риска, светло-серые — пониженного риска, белые — сочетание комбинаций генотипов отсутствует.
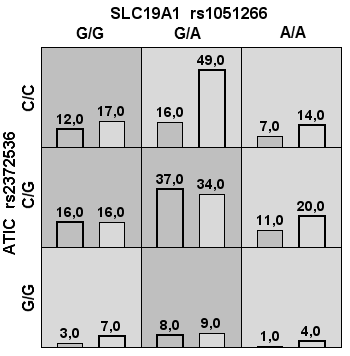
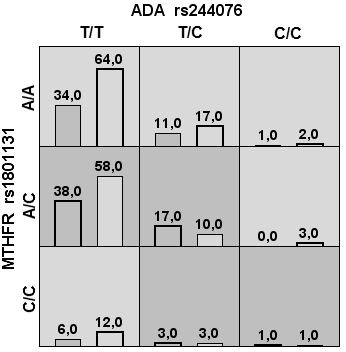
Автоматически созданные три двухгенные модели: «ATIC rs2372536 + MTHFR rs1801133», «ADA rs244076 + MTHFR rs1801131», «SLC19A1 rs1051266 + FPGS rs4451422» с высокой устойчивостью 10/10 также не продемонстрировали достаточной чувствительности и специфичности, таким образом, диагностическая эффективность составила 59,4; 55,4 и 59,0 (соответственно) (табл. 1, рис. 3).
 |  |  |
А | В | С |
Рис. 3. Столбчатые диаграммы числа пациентов в ячейках сочетания генотипов для ряда двухгенных моделей
Примечания: Столбцы слева — количество неответчиков, столбцы справа — число ответчиков на терапию; тёмно-серые ячейки — комбинации повышенного риска, светло-серые — пониженного риска, белые — сочетание комбинаций генотипов отсутствует.
Таким образом, автоматизированный поиск оптимальных моделей не позволил создать устойчивую модель с высокой диагностической эффективностью, так как подход опирался исключительно на математические критерии без учёта биохимических данных.
Информационный анализ. Для повышения качества прогностических моделей на следующем этапе был построен граф, представленный на рис. 4, отражающий вклад генов в отсутствие ответа на терапию, с использованием информационного анализа, основанного на энтропии Шеннона.
Эта мера неопределённости позволила оценить информационный выигрыш как разницу между вероятностными распределениями системы с учётом и без учёта определённых элементов. Граф представлен вершинами (гены) и рёбрами (их взаимодействия), где значения информационного выигрыша (в процентах) отражают вклад генов и их парного взаимодействия в общую энтропию. Толщина рёбер соответствует величине выигрыша, а цвет указывает на его характер: оранжевый и красный — на синергетическое неаддитивное (эпистатическое) взаимодействие, усиливающее эффект генов; зелёный и синий — на аддитивное взаимодействие с избыточностью информации; коричневые линии — на слабое или независимое влияние. Комбинация ATIC rs2372536 и SLC19A1 rs1051266 обеспечила выигрыш 3,11 % (2,03 % + 0,37 % + 0,71 %), превосходя комбинацию SLC19A1 rs1051266 и FPGS rs4451422 (2,46 %). Преобладание оранжевых и красных рёбер на графе подчёркивает доминирование эпистатических взаимодействий, особенно между SLC19A1 rs1051266 и полиморфизмами FPGS rs4451422 и rs1544105.
 | |
|
|
Рис. 4. Граф энтропии (сверху) и дендрограмма сходства (снизу) для вклада генов и их взаимодействий в риск неответа на терапию |
|
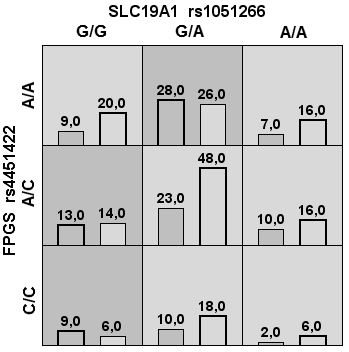
Дендрограмма сходства (рис. 4) выявила тесное неаддитивное взаимодействие между SLC19A1 rs1051266 и FPGS rs4451422, а также кластером GGH rs3758149 и FPGS rs1544105. Эти связи легли в основу биохимически обоснованной модели полиглютамации, включающей полиморфизмы, кодирующие белки внутриклеточного транспорта SLC19A1, полиглютамации FPGS и деглютамации GGH. Ферменты, кодируемые этими генами, последовательно участвуют во внутриклеточном транспорте и метаболизме МТ, определяя концентрацию его активной формы. Эпистатические взаимодействия этих генов отражены в модели с высокой статистической значимостью (p <0,001) и устойчивостью (табл. 2). Тем не менее диагностическая эффективность составила 65,1 % при низкой специфичности (60,0 %), что недостаточно для точного прогноза.
Итоговая модель объединила две пары генов, кодирующих аденозиновый и фолатный пути метаболизма МТ: ATIC rs2372536 с MTHFR rs1801133 и ADA rs244076 с MTHFR rs1801131. Внутри пар выявлена информационная избыточность, указывающая на аддитивное взаимодействие, связанное с биохимическими процессами. MTHFR и ATIC — ключевые ферменты, определяющие механизмы действия МТ: регулирование синтеза фолатов, аденозина и пуринов. Ген SLC19A1 rs1051266, включённый как пятый компонент, подтвердил значительную роль ферментов внутриклеточного транспорта МТ.
Таблица 2. Модели прогноза неответа на терапию по результатам MDR-анализа, созданных на основе биологической информации (nнеответ=111, nответ=170)
Чувствительность, % [95 % ДИ] Специфичность, % [95 % ДИ] Диагностическая эффективность | OR [95 % ДИ] | P | Надёжность модели в кросс-проверке | |
Модель полиглютамации | ||||
SLC19A1 rs1051266 + FPGS rs4451422 + FPGS rs1544105 + GGH rs3758149 | 70,3 [61,3; 78,2] 60,0 [52,5; 67,1] 65,1 | 3,55 [2,13; 5,90] | χ2(1)=24,65 р <0,001 | 10 /10 |
Итоговая модель | ||||
ATIC rs2372536 + ADA rs244076 + MTHFR rs1801133 + MTHFR rs1801131 + SLC19A1 rs1051266 | 80,2 [72,0; 86,8] 69,4 [60,4; 77,4] 74,8 | 9,18 [5,19; 16,22] | χ2(1)=66,06 р <0,001 | 10 /10 |
С использованием MDR проанализирован вклад 12 SNP 9 генов в риск неответа на МТ. Итоговая модель «ATIC rs2372536 + MTHFR rs1801133 + ADA rs244076 + MTHFR rs1801131 + SLC19A1 rs1051266» показала высокую статистическую значимость (p <0,001) и устойчивость при кросс-валидации (10/10) (табл. 2). Её решающее правило «если, то» обеспечивает прогноз риска с чувствительностью 80,2 % (95 % ДИ: 72,0;86,8) и специфичностью 69,4 % (95 % ДИ: 60,4;77,4). Практическое использование итоговой модели представлено во фрагменте таблицы решающего правила «если, то» (табл. 3). Модель запатентована, готова для практического применения [11].
Таблица 3. Решающее правило «если, то» для итоговой модели прогноза риска неответа на метотрексат по генетическим показателям: 1 — неответ, 0 — ответ (фрагмент)
Если | И | И | И | И | То |
SLC19A1 rs1051266 | ADA rs244076 | ATIC rs2372536 | MTHFR rs1801131 | MTHFR rs1801133 | Риск = |
GG | TT | CC | CC | CC | 1 |
GG | TT | CC | AA | CC | 0 |
GG | TT | CC | AA | CT | 0 |
GG | TT | CC | AA | TT | 0 |
GG | TT | CC | AC | CC | 1 |
GG | TT | CC | AC | CT | 0 |
GG | TT | GG | CC | CC | 1 |
GG | TT | GG | AA | CC | 0 |
Обсуждение
В последнее десятилетие медицинская наука стремится к новым способам повышения эффективности лечения различных заболеваний. В Российской Федерации приоритетным признано направление «Переход к персонализированной медицине, высокотехнологичному здравоохранению и технологиям здоровьесбережения, в том числе за счёт рационального применения лекарственных препаратов» [12]. В ревматологии такие задачи касаются терапии РА, как самого распространённого и социального значимого заболевания. Персонализированный подход к лечению может быть реализован путём изучения генов-регуляторов метаболизма МТ, как фармпрепарата первой линии РА. Исследовательская деятельность нашего коллектива в фармакогенетике эффективности и переносимости МТ при РА ведётся с 2013 года. За это время изучены вопросы комплексного механизма действия МТ, получены данные о некоторых генетических полиморфизмах, влияющих на терапевтический ответ [13–15]. Понимание сложности реализации эффектов МТ послужило стимулом для дальнейшей работы и внедрения фармакогенетического тестирования в практику. Для этой цели была предварительно разработана отечественная валидированная тест-система, и кандидатным подходом предопределены ключевые биомаркеры терапевтического ответа на МТ. Следующим этапом стал поиск прогностической фармакогенетической модели. Первая попытка создания такой модели базировалась на автоматическом (машинном) анализе без учёта принципов метаболизма МТ. Этот способ не принёс ожидаемых результатов. Вторая попытка создания модели основывалась на неаддитивном взаимодействии генов с учётом метаболизма МТ. Полученная итоговая модель показала хорошую прогностическую ценность и стабильность при кросс-проверке. Результатом такого пошагового подхода стало создание программы ЭВМ для принятия решения о целесообразности инициации базисного лечения МТ. Т. к. данные получены на европейской популяции надёжность, и воспроизводимость результатов в РФ на большинстве территорий может быть высокая.
Таким образом, десятилетнее исследование прогнозирования эффективности МТ при РА привело: к алгоритмизации построения модели прогноза эффективности фармпрепарата; разработке отечественной тест-системы для генетического типирования «ATIC rs2372536 + MTHFR rs1801133 + ADA rs244076 + MTHFR rs1801131 + SLC19A1 rs1051266»; практической реализации результатов исследования с помощью программы ЭВМ.
Ограничения исследования
Ограничением исследования является умеренная специфичность итоговой модели (69,4 %), что может снижать её прогностическую ценность в некоторых клинических сценариях. Лимитированный объём выборки и её одноцентровый характер могут не в полной мере отражать генетическую гетерогенность популяции. Отсутствие учёта эпигенетических факторов и данных об экспрессии генов также ограничивает полноту анализа.
Заключение
Итоговая модель, объединяющая пять полиморфизмов «ATIC rs2372536 + MTHFR rs1801133 + ADA rs244076 + MTHFR rs1801131 + SLC19A1 rs1051266», демонстрирует высокую чувствительность и устойчивость, открывая перспективы для персонализированного подхода к лечению. Несмотря на ограничения, связанные с умеренной специфичностью и одноцентровым дизайном, результаты фармакогенетического подхода создают основу для дальнейших исследований, направленных на оптимизацию терапии РА.
Учёт биохимических процессов при разработке фармакогенетических моделей позволяет глубже понять взаимодействие генов, что имеет решающее значение для повышения диагностической эффективности итоговой модели. В конечном счёте увеличивается точность прогнозирования терапевтического ответа на МТ. Для реализации исследования разработана тест-система отечественного производства, что позволит внедрить фармакогенетическое типирование в клиническую в практику.
Список литературы
1. Sherbini AA, Gwinnutt JM, Hyrich KL; RAMS Co-Investigators; Verstappen SMM. Rates and predictors of methotrexate-related adverse events in patients with early rheumatoid arthritis: results from a nationwide UK study. Rheumatology (Oxford). 2022 Oct 6;61(10):3930-3938. doi: 10.1093/rheumatology/keab917.
2. Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis. 2010 Sep;69(9):1580-8. doi: 10.1136/ard.2010.138461.
3. Насонов Е.Л., Лила А.М., Дубинина Т.В., и др. К 60-летию журнала «Научно-практическая ревматология» Достижения ревматологии в начале XXI века. Научно-практическая ревматология. 2022;60(1):5-20. doi:10.47360/1995-4484-2022-5-20.
4. Министерство здравоохранения Российской Федерации. Клинические рекомендации: Ревматоидный артрит. Москва: Минздрав России; 2024. Доступно по: https://www.consultant.ru/document/cons_doc_LAW_495885/. Ссылка активна на 19.06.2025.
5. Fraenkel L, Bathon JM, England BR, et al. 2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken). 2021 Jul;73(7):924-939. doi: 10.1002/acr.24596.
6. Duong SQ, Crowson CS, Athreya A, Atkinson EJ, Davis JM 3rd, Warrington KJ, Matteson EL, Weinshilboum R, Wang L, Myasoedova E. Clinical predictors of response to methotrexate in patients with rheumatoid arthritis: a machine learning approach using clinical trial data. Arthritis Res Ther. 2022 Jul 1;24(1):162. doi: 10.1186/s13075-022-02851-5.
7. Sergeant JC, Hyrich KL, Anderson J, et al. Prediction of primary non-response to methotrexate therapy using demographic, clinical and psychosocial variables: results from the UK Rheumatoid Arthritis Medication Study (RAMS). Arthritis Res Ther. 2018 Jul 13;20(1):147. doi: 10.1186/s13075-018-1645-5.
8. Floris A, Perra D, Cangemi I, et al. Current smoking predicts inadequate response to methotrexate monotherapy in rheumatoid arthritis patients naïve to DMARDs: Results from a retrospective cohort study. Medicine (Baltimore). 2021 Apr 30;100(17):e25481. doi: 10.1097/MD.0000000000025481.
9. de Rotte MCFJ, Pluijm SMF, de Jong PHP, et al. Development and validation of a prognostic multivariable model to predict insufficient clinical response to methotrexate in rheumatoid arthritis. PLoS One. 2018 Dec 10;13(12):e0208534. doi: 10.1371/journal.pone.0208534.
10. Jeiziner C, Allemann SS, Hersberger KE, et al. Is Pharmacogenetic Panel Testing Applicable to Low-Dose Methotrexate in Rheumatoid Arthritis? A Case Report. Pharmgenomics Pers Med. 2022 May 9;15:465-475. doi: 10.2147/PGPM.S354011.
11. Патент РФ для программы ЭВМ № 2024691240/03.12.24. Девальд И.В., Лила А.М., Хромова Е.Б. Прогноз эффективности метотрексата при ревматоидном артрите по результатам генотипирования пациента. Доступно по https://www.elibrary.ru/item.asp?id=76408958. Ссылка активна на 29.06.2025.
12. Сычёв Д.А. Переход к персонализированной медицине — приоритет научно-технологического развития России. Фармакогенетика и фармакогеномика. 2017;(1):3-4.
13. Девальд И. В., Ходус Е. А., Мысливцова К. Ю., и др. Влияние полиморфизмов генов ATIC, ADA, ITPA, AMPD1 на эффективность метотрексата при ревматоидном артрите. Фармакогенетика и фармакогеномика. 2024;(1):4-13. doi: 10.37489/2588-0527-2024-1-4-13. EDN: KCZHLK.
14. Девальд И.В., Ходус Е.А., Нохрин Д.Ю., и др. Оценка влияния полиморфизмов генов-транспортеров (RFC1, MDR1) и GGH на эффективность метотрексата при ревматоидном артрите. Современная ревматология. 2023;17(4):28-34. doi: 10.14412/1996-7012-2023-4-28-34.
15. Девальд И.В., Ходус Е.А., Хромова Е.Б., и др. Ассоциация полиморфизмов генов-транспортеров RFC-1 и MDR1 с терапевтическим ответом на метотрексат у больных ревматоидным артритом. Вестник Челябинского государственного университета Образование и здравоохранение. 2022;19(3):5-14. doi: 10.24411/2409-4102-2022-10301.
Об авторах
И. В. ДевальдРоссия
Девальд Инесса Валерьевна — к. м. н., доцент кафедры терапии ИДПО ФГБОУ ВО ЮУГМУ Минздрава России.
Челябинск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
К. Ю. Мысливцова
Россия
Мысливцова Кристина Юрьевна — старший лаборант кафедры терапии ИДПО ФГБОУ ВО ЮУГМУ Минздрава России.
Челябинск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. М. Лила
Россия
Лила Александр Михайлович — д. м. н., член-корр. РАН, профессор, директор ФГБНУ НИИР им. В.А. Насоновой, Москва, Российская Федерация; заведующий кафедрой ревматологии ФГБОУ ДПО РМАНПО Минздрава России.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Е. А. Ходус
Россия
Ходус Елена Андреевна — к. м. н., врач-ревматолог.
Челябинск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Е. Б. Хромова
Россия
Хромова Елена Борисовна — к. б. н., руководитель регистра доноров ГСК ФГБУ РосНИИГТ ФМБА России.
Санкт-Петербург
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Что уже известно об этой теме?
Ревматоидный артрит (РА) — хроническое аутоиммунное заболевание, а метотрексат (МТ) является основным базисным препаратом для его лечения.
Эффективность МТ ограничена: около 30% пациентов не отвечают на терапию из-за недостаточной эффективности или побочных эффектов.
Основная проблема — отсутствие надежных инструментов для прогнозирования ответа на МТ до начала лечения.
Ведутся исследования по поиску генетических маркеров (однонуклеотидных полиморфизмов, SNP), связанных с механизмом действия МТ.
Что нового даёт статья?
Разработана и валидирована новая фармакогенетическая модель для прогнозирования неответа на терапию метотрексатом.
Модель включает комбинацию из пяти полиморфизмов в генах: ATIC rs2372536, MTHFR rs1801133, ADA rs244076, MTHFR rs1801131 и SLC19A1 rs1051266.
Показано, что учет биохимических путей метаболизма МТ (фолатного и аденозинового) критически важен для создания эффективной модели, в отличие от чисто математического подхода.
Модель обладает высокой чувствительностью (80.2%) и стабильностью (устойчива при кросс-валидации 10/10).
Для практического применения модели разработана отечественная тест-система и создано программное обеспечение с "если-то" решающими правилами.
Как это может повлиять на клиническую практику в обозримом будущем?
Внедрение этой модели позволит перейти к персонализированному подходу в лечении РА.
Врач сможет до начала терапии с помощью генетического теста оценить вероятность ответа пациента на метотрексат.
Это позволит:
Пациентам с высоким прогнозируемым риском неответа быстрее назначать альтернативную терапию (биологические препараты, ингибиторы Янус-киназы), не теряя время на неэффективный МТ.
Повысить общую эффективность лечения и скорость достижения ремиссии.
Снизить риск неоправданных побочных эффектов у пациентов, которым МТ не поможет.
Рецензия
Для цитирования:
Девальд И.В., Мысливцова К.Ю., Лила А.М., Ходус Е.А., Хромова Е.Б. Фармакогенетическая модель прогнозирования терапевтического ответа на метотрексат у пациентов с ревматоидным артритом. Фармакогенетика и фармакогеномика. 2025;(2):30-39. https://doi.org/10.37489/2588-0527-2025-2-30-39. EDN: OEWJGS
For citation:
Devald I.V., Myslivtsova K.Yu., Lila A.M., Khodus E.A., Khromova E.B. Pharmacogenetic model for predicting therapeutic response to methotrexate in patients with rheumatoid arthritis. Pharmacogenetics and Pharmacogenomics. 2025;(2):30-39. (In Russ.) https://doi.org/10.37489/2588-0527-2025-2-30-39. EDN: OEWJGS