Перейти к:
Генетические факторы, способствующие развитию метаболического синдрома
https://doi.org/10.37489/2588-0527-2024-2-5-12
EDN: USTDYY
Аннотация
В последнее время роль метаболического синдрома (МС) стала очень велика. Существует тенденция к увеличению данного заболевания не только в Российской Федерации, но и во всём мире. По данным ВОЗ 2022 г. сообщается, что около 60 % населения Европы имеет избыточную массу тела или ожирение. Известно, что США и Россия, представляют страны с наибольшим количеством жителей с ожирением. МС зачастую встречается преимущественно в развитых странах, в основном, у взрослого населения и является коморбидной патологией. Именно наличие МС увеличивает риск развития инвалидизации и смертности в будущем. Несмотря на факторы внешней среды, которые увеличивают риск развития МС, на сегодняшний день существует генетический компонент, также участвующий в развитии данной патологии. Среди генов выделяют те, которые участвуют в развитии МС: MC4R, LEP, LEPR, PCSK1, ADCY3, POMC, MRAP2. Эти гены принимают участие в лептин-меланокортиновом сигнальном пути, а именно регулируют энергетический обмен, что при возникновении мутации, приводит к несиндромальному моногенному ожирению. МС является многофакторным патологическим состоянием, которое включает в себя четыре самостоятельных подсиндрома: ожирение или избыточная масса тела, артериальная гипертензия, дислипидемия, инсулинорезистентность. В данной статье отображены особенности генов, способствующих развитию МС, а также клинические особенности течения данной патологии.
Ключевые слова
Для цитирования:
Калашникова К.Е., Шрайнер Е.В., Быстрова В.И., Лифшиц Г.И. Генетические факторы, способствующие развитию метаболического синдрома. Фармакогенетика и фармакогеномика. 2024;(2):5-12. https://doi.org/10.37489/2588-0527-2024-2-5-12. EDN: USTDYY
For citation:
Kalashnikova C.E., Shrayner E.V., Bystrova V.I., Lifshits G.I. Genetic factors contributing to the development of metabolic syndrome. Pharmacogenetics and Pharmacogenomics. 2024;(2):5-12. (In Russ.) https://doi.org/10.37489/2588-0527-2024-2-5-12. EDN: USTDYY
Введение
Одной из ведущих глобальных проблем общественного здравоохранения на сегодняшний день является метаболический синдром (МС). Распространённость МС увеличивается с каждым годом. Известно, что за последние 40 лет, заболеваемость МС удвоилась, что привело к тому, что на сегодняшний день данной патологией поражена треть населения. Большая часть людей с избыточной массой тела проживает в Мексике — 41 %, США — 34,7 % и России — 31 %, по результатам первого национального эпидемиологического кросс-секционного исследования (NATION) [3–5]. За последние несколько десятилетий распространённость ожирения в России увеличилась в 4 раза среди мужчин и в 1,5 раза среди женщин [6]. По данным метаанализа проведённого в Азии с 2008 по 2015 гг., распространённость МС среди взрослого населения составила 24,5 % [3]. В 2016 г. распространённость ожирения в возрасте от 5 до 19 лет составила около 124 млн человек [4].
МС — это патологическое состояние, в результате которого возникает снижение чувствительности периферических тканей к воздействию инсулина, в результате чего происходит нарушение липидного, углеводного и пуринового обмена. Известно, что центральное ожирение (висцеральная жировая ткань), чаще способствуют развитию МС с развитием осложнений [7, 8]. Существует множество факторов, способствующих развитию МС, это, например: географическое положение, этническая принадлежность, внешнее воздействие окружающей среды, пол, возраст, а также генетическая предрасположенность (рис. 1) [9]. Вклад генетики помогает лучше разбираться в истинных причинах возникновения МС, а также улучшает раннюю диагностику данной патологии [5]. При полногеномном ассоциативном исследовании (GWAS) было идентифицировано около 200 генетических полиморфных вариантов, ассоциированных с ожирением и более 4 200 вариантов, ассоциированных с увеличенным индекса массы тела (ИМТ). Этот анализ показал, что определённые локусы с включёнными генами являются главными регулирующими структурами в жировом обмене, продукты которых принимают участие в контроле аппетита, чувстве насыщения, выработке инсулина, образовании адипоцитов, а также в энергетическом метаболизме [2].

Рис. 1. Факторы риска развития метаболического синдрома
Генетические аспекты возникновения метаболического синдрома
На сегодняшний день известно около 50 генов, участвующих в развитии основного критерия МС — ожирении [9]. Мутации, возникшие в этих генах, участвуют в лептин-меланокортиновом сигнальном пути и приводят к нарушению энергетического и липидного гомеостаза [10, 11].
Тяжёлые мутации, по данным последних исследований, происходят в рецепторе лептина (LEPR), лептине, проопиомеланокортине (ПОМК, кортикотропин-подобный иммунный пептид), рецепторе меланокортина 4 (MC4R) и пропротеинконвертазе субтилизин/кексин типа 1 (PCSK1) [12].
Лептин, являясь пептическим гормоном, синтезируется клетками жировой ткани, и передаёт в гипоталамус сигнал о насыщении во время приёма пищи. Мутация, возникшая при кодировании гена LEP, способствует развитию тяжёлого раннего ожирения и гиперфагии. Описано около 100 пациентов во всём мире с наличием данной патологии [12].
Мутации LEPR наследуются по аутосомно-рецессивному типу. Чаще всего гомозиготные пациенты встречаются в близкородственных браках, и у таких пациентов часто возникают тяжёлые клинические проявления. На сегодняшний день известно 6 вариантов сплайсинга рецептора лептина и все они различаются лишь С-концевой областью [5]. LEP-Rb (рецептор лептина) экспрессируется в гипоталамусе и участвует в регуляции потребления пищи и в расходе энергии. Когда лептин связывается с рецептором, он образует димер или олигомер с комплексами лептин-лептинового рецептора и индуцирует JAK2 (янус-киназу 2). JAK2 является тирозинкиназой, активирующей гены путём транскрипции. Фосфорилированная JAK2 фосфорилирует IRS, в следствие чего возникает активация сигнального пути PI3K/AKT, киназы AKT фосфорилируют FOXO1 (фактор транскрипции), исходом которого является перемещение pFOXO1, в результате, в организме, происходит подавление приёма пищи. Возникшая мутация в рецепторе лептина (LEPR) приводит к раннему появлению чувства голода, а также к бесплодию, быстрому росту организма и метаболическим нарушениям, а именно к возникновению повышенной резистентности тканей к воздействию инсулина [5, 12].
Достаточно распространённой является мутация MC4R (ген рецептора меланокортина-4). По последним данным от 0,2 до 8,5 % случаев тяжёлого ожирения у детей вызваны мутациями в данном гене. Ген рецептора меланокортина-4 (MC4R) экспрессируется в паравентрикулярных ядрах гипоталамуса (PVN). Ген MC4R является частью G-белка (GPCR), который связывается с α-меланоцитстимулирующим гормоном (α-MSH). В последующем возникает активация аденилатциклазы-3 (ADCY3), которая превращает аденозинтрифосфат (АТФ) в циклический монофосфат (цАМФ). Уровень в клетке цАМФ, активирует протеинкиназа А (PKA), которая в свою очередь регулируется внеклеточными молекулами (ERK) и АМФ (CREB), тем самым осуществляя важную роль в регуляции потребления и расхода энергии [5, 13]. Потеря функции данного гена зачастую связана с ожирением и в совокупности с развитием метаболического синдрома. Адипонектин, гормон жировой ткани, который повышает чувствительность тканей к инсулину, дефицит MC4R приводит к снижению уровня данного гормона, тем самым способствуя развитию метаболического синдрома. Различают несколько полиморфизмов гена MC4R: rs12970134 и rs17782313. В проведённых исследованиях доказано, что оба варианта влияют на развитие ожирения и коррелируют с повышенным ИМТ. Известно, что rs17782313 больше влияет на развитие центрального ожирения, так как rs12970134 способствует развитию инсулинорезистентности [10, 14, 15].
Мутация в гене POMC (дефицит проопиомеланокортина) клинически проявляется с первых месяцев жизни и является тяжёлой патологией. POMC связывается с MC4R и подавляет аппетит, участвует в регуляции энергетического обмена. Данная мутация характеризуется нарушением пищевого поведения, развитием ожирения, с манифестацией в раннем возрасте, рыжим цветом волос. Патология является достаточно редкой, на сегодняшний день в литературе описано около 50 случаев [5, 16].
При мутации в гене PCSK1 (прогормона конвертазы 1), возникает частичный дефицит фермента пропротеин-конвертазы 1 типа (PC1/3), которая принимает участие в процессинге проинсулина и проглюкагона в поджелудочной железе. Дефект происходит в участке гена p.Y181H (rs145592525), в следствие чего, происходит нарушение синтеза фермента пропротеин-конвертазы 1 типа. Дефицит проявляется морбидным ожирением, несахарным диабетом, снижением уровня соматотропина и тиреотропного гормона (ТТГ) [16, 17].
ADCY3 (аденилатциклаза 3) является геном, привлекающим всё большее внимание врачей. Ген ADCY3 кодирует аденилатциклазу (АЦ) в гипоталамусе, в следствие этого происходит потеря сигнала от цАМФ и нарушается меланокортиновый путь, который отвечает за регуляцию пищевого поведения и энергетический обмен. Потеря функции ADCY3 проявляется абдоминальным ожирением у детей, развитием сахарного диабета 2 типа и аносмией [16, 18].
MRAP2 является трансмембранным вспомогательным белком рецептора меланокортина 2. Основной функцией данного фермента является влияние на локализацию и передачу сигналов рецептора меланокортина 2 и стимуляция выработки цАМФ. Дефекты в MRAP2 приводят к нарушению регуляции контроля аппетита, дисрегуляции энергетического гомеостаза, в следствие чего развивается ожирение, гипергликемия и артериальная гипертензия [16, 19].
Основные механизмы развития метаболического синдрома
В патогенезе МС выделяют три основных механизма развития: висцеральное ожирение, инсулинорезистентность и артериальная гипертензия (рис. 2). Метаболический синдром — это патологическое состояние, включающее в себя группу метаболических нарушений, таких как избыточная масса тела, артериальная гипертензия, дислипопротеинемия, нарушение метаболизма глюкозы (см. рис. 2). МС развивается на фоне инсулинорезистентности тканей организма. При развитии метаболического синдрома происходит активация симпатоадреналовой системы и ренин-ангиотензин-альдостероновой системы [8, 20].
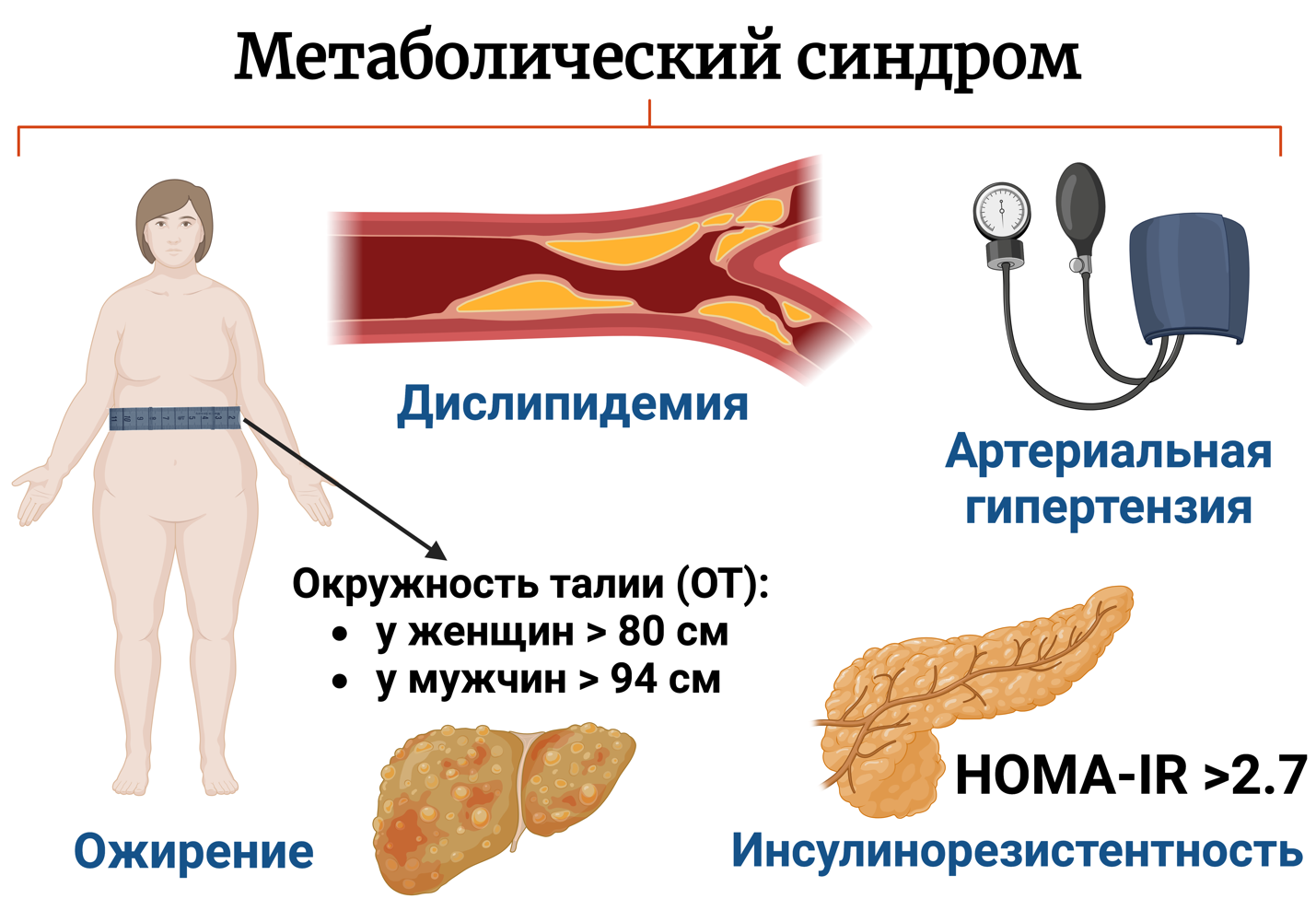
Рис. 2. Метаболический синдром и его составляющие
Инсулин — это пептидный гормон поджелудочной железы, который участвует в ингибировании липолиза и глюконеогенеза в печени, в ответ на высокий уровень глюкозы. С возникновением инсулинорезистентности в жировой ткани нарушается липолиз, увеличивается количество свободных жирных кислот. Свободные жирные кислоты, в свою очередь влияют на активность фермента фосфоинозитид-3-киназы (сигнальный путь PI3K), приводя к снижению инсулинзависимого белка — переносчика глюкозы (GLUT-4), и, следовательно, поглощение глюкозы снижается. Также свободные жирные кислоты увеличивают глюконеогенез и липогенез. В результате этого возникает гиперинсулинемическое состояние [21, 22].
В развитии МС важную роль играют маркеры воспаления и адипокины. Лептин — это пептидный гормон, который регулирует энергетический обмен. При достаточных запасах энергии, лептин подавляет чувство голода, и стимулирует расход энергии. При возникновении метаболического дисбаланса в организме, возникает резистентность к лептину, тем самым снижется чувствительность тканей к воздействию лептина. При возникновении избытка пептидного гормона у пациентов с генетическими нарушениями, возникает гиперфагия и набор массы тела. Достаточно длительное время считалось, что избыток лептина в организме также приводит к развитию артериальной гипертензии. На сегодняшний день, существуют исследования, которые опровергают эту связь [22, 23].
Адипонектин является противовоспалительным гормоном, который также участвует в развитии МС. Он влияет на В-клетки (NF-kB) воспалительного внутриклеточного сигнального пути, и принимает участие в ингибировании пролиферации гладкомышечных клеток сосудов, повышая чувствительность к инсулину. Адипонектин усиливает метаболизм глюкозы и контролирует энергетический гомеостаз [22, 23]. Также адипонектин обладает инсулиноподобными свойствами, с его помощью происходит захват глюкозы мышечными и жировыми клетками при помощи глюкозного транспортера (GLUT-4), угнетая глюконеогенез и липолиз в организме человека [24, 25]. На сегодняшний день, у большинства пациентов с метаболическим синдромом присутствует пониженный уровень адипонектина в сыворотке крови. У здоровых людей пониженный уровень адипонектина увеличивает риск развития МС, примерно, в три раза, по сравнению с пациентами, у которых присутствует высокий уровень данного гормона [23].
Важной составляющей частью патогенеза МС является хроническое воспаление. При избыточной массе тела или ожирении, основным критерием МС, возникает системное воспаление, с высвобождением в кровь острофазовых белков и медиаторов воспаления (рис. 3) [26]. Возникшая в процессе времени резистентность к инсулину и вызванный ожирением окислительный стресс активируют каскады воспаления, что в последствии приводит к фиброзированию тканей и повреждению сосудов посредством развития атеросклероза [22]. С-реактивный белок (СРБ) является высокочувствительным биомаркером при повреждении ткани. У пациентов с МС, нередко отмечается его повышение, определение концентрации уровня СРБ можно использовать в качестве полезного биомаркера для определения МС [23].
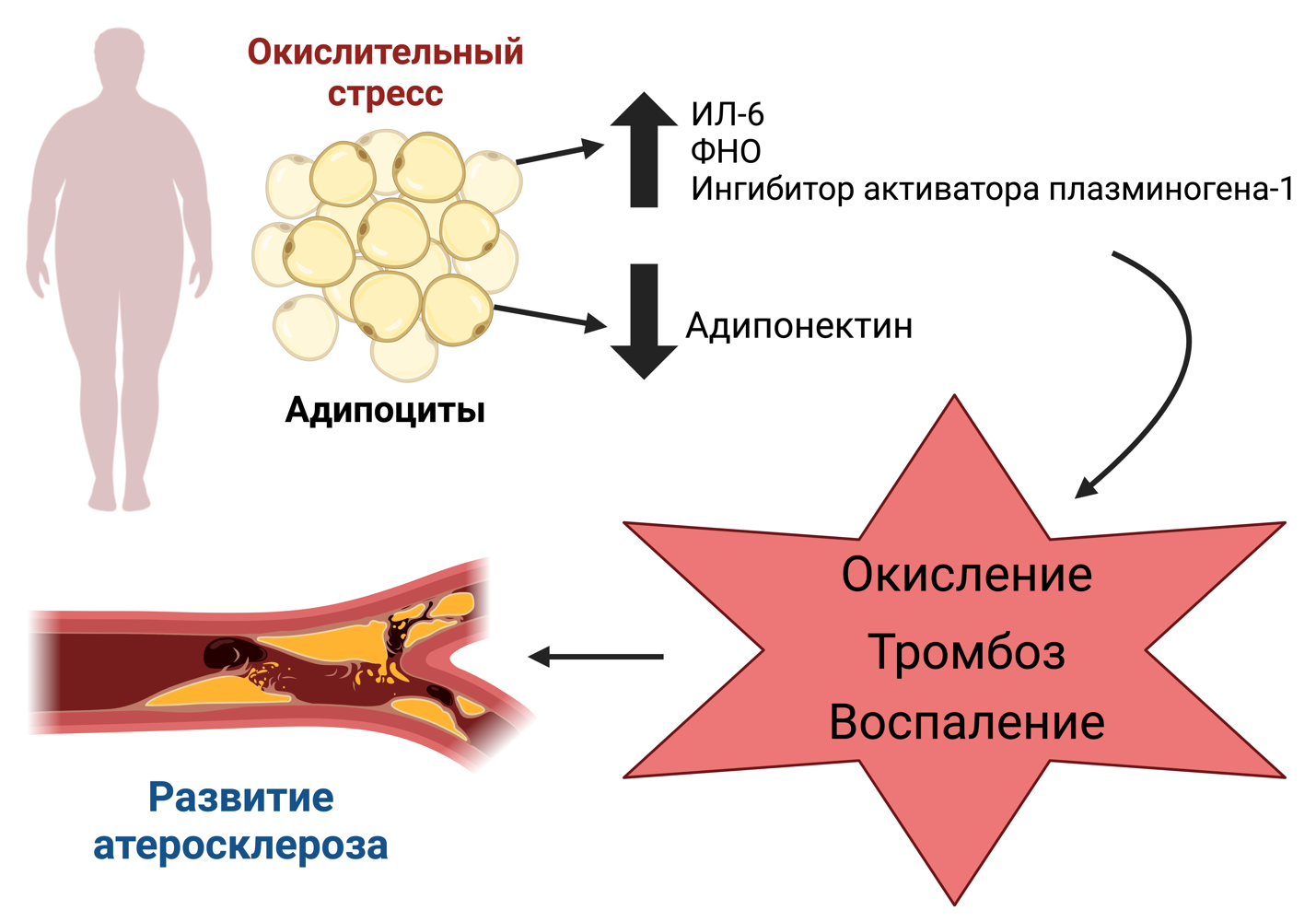
Рис. 3. Окислительный стресс и метаболический синдром
При метаболическом синдроме, происходит активация макрофагов и увеличивается синтез Th 1 типа и Th 17 типа, в результате этого возникает системный воспалительный ответ с высвобождением цитокинов [27]. IL-6 относится к провоспалительным цитокинам и обладает гипергликемическим эффектом. IL-6 участвует в регуляции жирового и углеводного обмена, запуская в печени противовоспалительный каскад ферментов [22]. Тканевой фактор (фактор свёртывания крови III), синтезируемый макрофагами жировой ткани, запускает внешний путь коагуляционного гемостаза, в следствие этого, возникает синтез в печени проконвертина (фактор свёртывания крови VII) и фактора фон Виллебранда. Тканевой фактор ускоряет процесс превращения IX фактора и X фактора в их активные формы, что способствует образованию фибрина, в следствие чего увеличивается риск развития тромбозов [27]. IL-6 снижает выработку гликогена в печени, а также подавляет чувствительность рецепторов инсулина, что в дальнейшем приводит к инсулинорезистентности [22].
Метаболический синдром как фактор развития онкогенеза
Метаболический синдром, является не только фактором развития сердечно-сосудистых заболеваний, сахарного диабета 2 типа, но и увеличивает риск образования онкологического процесса. На сегодняшний день известно, что основные и дополнительные критерии МС, увеличивающие риск развития около 13 видов рака: рак пищевода, желудка, толстой и прямой кишки, печени, простаты, яичников, почек, опухоль мозговых оболочек, щитовидной железы и множественная миелома [28–30].
Ожирение — это хронический, воспалительный процесс, который способствует нарушению дифференцировки преадипоцитов, гипертрофии адипоцитов, активации макрофагов, приводит к выбросу цитокинов и хемокинов. Дисфункция гомеостаза жировой ткани приводит к гибели части адипоцитов, с образованием распада триглицеридов и высвобождением жирных кислот. В такой воспалительной среде высвобождаются свободные радикалы, происходит повреждение ДНК, увеличивается риск развития мутаций [29, 30]. В жировой ткани поддерживают воспалительный процесс резидентные макрофаги и микроРНК. МикроРНК — это малые не кодирующие молекулы РНК, состоящие из 19–23 нуклеотидов, участвующие в транскрипционной и посттранскрипционной регуляции экспрессии генов методом РНК-интерференции. Около сотни микроРНК может регулировать от 30 до 80 % генов. МикроРНК необходима для правильной регуляции клеточных процессов, участвуя в пролиферации клеток, клеточном метаболизме и синтезе белка. При дисрегуляции, действие микроРНК приводит к аномальному росту и биосинтезу патологических клеток, которые способствуют развитию онкологического процесса. Именно деятельность микроРНК в жировой ткани пациентов с МС играет решающую роль в прогрессировании опухоли и образовании метастаз [29, 31, 32].
Практически все виды микроРНК связаны с пролиферацией, ростом, гибелью клеток, развитием метастатического поражения. Примерно у 50 % пациентов с раком шейки матки определяется увеличение количества копий DROSHA (фермент рибонуклеазы III класса 2). Группа микроРНК-130 включающая микроРНК-130a и микроРНК-130b связаны именно с прогрессированием онкологического процесса. Высокие уровни микроРНК-130b часто обнаруживаются на III-IV стадии онкологического процесса у пациентов с колоректальным раком. МикроРНК-21 участвует в адипогенной дифференцировке мезенхимальных стволовых клеток. МикроРНК-21 определяется при опухолях поджелудочной железы, толстой кишки, молочной железы, глиобластоме, колоректальном раке с поздней стадией метастазирования. Также она связана с антиапоптотическим действием, способствуя пролиферации клеток путём воздействия на опухолевый супрессор. МикроРНК-193, напротив, обладает противоопухолевым эффектом при раке молочной железы снижая пролиферацию и миграцию клеток [29, 31].
У пациентов с метаболическим синдромом увеличивается риск развития онкологических заболеваний в несколько раз, по сравнению со здоровыми людьми. МикроРНК, полученные из жировой ткани, играют очень важную роль в адипогенезе, жировом и гормональном гомеостазе. На сегодняшней день известно, что роль микроРНК очень велика в развитии онкологического процесса, доказано, что она участвует в прогрессировании и инвазии рака. Посредством этих исследований в дальнейшем будет определена противораковая терапия [32].
Заключение
Метаболический синдром является современным заболеванием. За последние несколько лет его распространённость увеличилась в несколько раз. МС — это мультифакториальное заболевание, основными компонентами его развития являются: ожирение, инсулинорезистентность и развившаяся артериальная гипертензия. Патогенез данного заболевания ещё до конца не изучен, но известно что на развитие данной патологии влияют эпигенетические факторы: малоподвижный образ жизни, нерациональное питание, нарушение режима дня, а также мутации в генах: ADCY3, ADIPOQ, ALMS1, ARL6, BBS1, BBS10, BBS12, BBS2, BBS4, BBS5, BBS6, BBS7, BBS9, BDNF, CEP19, CEP290, FTO, GNAS, GPC3, INSIG2, KSR2, LEP, LEPR, LZTFL1, MC4R, MKKS, MKS1, NEGR1, NTRK2, OFD1, PCSK1, PHF6, POMC, PRKAR1A, RAB23, RAI1, SDCCAG8, SH2B1, SIM1, TBX3, TMEM18, TRIM32, TTC8, VPS13B, WDPCP, WNT10B.
Наука не стоит на месте, и, с каждым днём проводится всё больше исследований, которые доказывают именно генетическую теорию развития МС. Понимание механизмов развития данного синдрома, правильная тактика лечения и составленный план реабилитации помогут снизить смертность от сердечно-сосудистых заболеваний и онкологии в будущем. Эти данные будут полезны врачам всех специальностей, для терапевтического лечения пациентов с МС, с целью уменьшения метаболических нарушений. Знание генетических предикторов МС с практической точки зрения даёт инструменты для работы врачей в направлении профилактики возникновения патологии, при лечение уже существующего заболевания подбор персонализированной терапии.
Список литературы
1. Boutari C, Mantzoros CS. A 2022 update on the epidemiology of obesity and a call to action: as its twin COVID-19 pandemic appears to be receding, the obesity and dysmetabolism pandemic continues to rage on. Metabolism. 2022 Aug;133:155217. https://doi.org/10.1016/j.metabol.2022.155217.
2. Timasheva YR, Balkhiyarova ZR, Kochetova OV. [Current state of the obesity research: genetic aspects, the role of microbiome, and susceptibility to COVID-19]. Probl Endokrinol (Mosk). 2021 Aug 2;67(4):20-35. Russian. https://doi.org/10.14341/probl12775.
3. Vrdoljak J, Kumric M, Vilovic M, et al. Can Fasting Curb the Metabolic Syndrome Epidemic? Nutrients. 2022 Jan 20;14(3):456. https://doi.org/10.3390/nu14030456.
4. Niazi RK, Gjesing AP, Hollensted M, et al. Screening of 31 genes involved in monogenic forms of obesity in 23 Pakistani probands with earlyonset childhood obesity: a case report. BMC Med Genet. 2019 Sep 5;20(1):152. https://doi.org/10.1186/s12881-019-0886-8.
5. Киселева А.В., Мешков А.Н., Ершова А.И., и др. Генетика ожирения: современное состояние проблемы. Профилактическая медицина. 2021;24(12):89 96. https://doi.org/10.17116/profmed20212412189.
6. Алфёрова В.И., Мустафина С.В. Распространенность ожирения во взрослой популяции Российской Федерации (обзор литературы). Ожирение и метаболизм. 2022;19(1):96-105. https://doi.org/10.14341/omet12809.
7. Осадчук М.А., Васильева И.Н., Козлов В.В., Митрохина О.И. Метаболический синдром как фактор риска онкогенеза. Профилактическая медицина. 2023;26(1):70 79. https://doi.org/10.17116/profmed20232601170.
8. Mendonça PDS, Aguiar APN, Pinheiro RF, Magalhães SMM. Metabolic syndrome: A patient-related prognostic factor for cancer? J Cancer Res Ther. 2022 Jul-Sep;18(4):1210-1211. https://doi.org/10.4103/jcrt.JCRT_323_19.
9. Шрайнер Е.В., Кох Н.В., Лифшиц Г.И. Ассоциация средовых факторов с избыточной массой тела и ожирением у детей дошкольного и младшего школьного возраста. Сибирский журнал клинической и экспериментальной медицины. 2021;36(3):148-153. https://doi.org/10.29001/2073-8552-2021-36-3-148-153.
10. Hainer V, Aldhoon Hainerová I, Kunešová M, et al. Melanocortin pathways: suppressed and stimulated melanocortin-4 receptor (MC4R). Physiol Res. 2020 Sep 30;69(Suppl 2):S245-S254. https://doi.org/10.33549/physiolres.934512.
11. Wu Q, Li J, Sun X, et al. Multi-stage metabolomics and genetic analyses identified metabolite biomarkers of metabolic syndrome and their genetic determinants. EBioMedicine. 2021 Dec;74:103707. https://doi.org/10.1016/j.ebiom.2021.103707.
12. Berger C, Klöting N. Leptin Receptor Compound Heterozygosity in Humans and Animal Models. Int J Mol Sci. 2021 Apr 25;22(9):4475. https://doi.org/10.3390/ijms22094475.
13. Mohammed I, Selvaraj S, Ahmed WS, et al. Functional Characterization of Novel MC4R Variants Identified in Two Unrelated Patients with Morbid Obesity in Qatar. Int J Mol Sci. 2023 Nov 15;24(22):16361. https://doi.org/10.3390/ijms242216361.
14. Yang Y, Gao X, Tao X, et al. Combined effect of FTO and MC4R gene polymorphisms on obesity in children and adolescents in Northwest China: a case-control study. Asia Pac J Clin Nutr. 2019;28(1):177-182. https://doi.org/10.6133/apjcn.201903_28(1).0023.
15. Batarfi AA, Filimban N, Bajouh OS, et al. MC4R variants rs12970134 and rs17782313 are associated with obese polycystic ovary syndrome patients in the Western region of Saudi Arabia. BMC Med Genet. 2019 Aug 20;20(1):144. https://doi.org/10.1186/s12881-019-0876-x.
16. Тимашева Я.Р., Балхиярова Ж.Р., Кочетова О.В. Современное состояние исследований в области ожирения: генетические аспекты, роль микробиома и предрасположенность к COVID-19. Проблемы Эндокринологии. 2021;67(4):20-35. https://doi.org/10.14341/probl12775.
17. Van Dijck E, Beckers S, Diels S, et al. Rare Heterozygous PCSK1 Variants in Human Obesity: The Contribution of the p.Y181H Variant and a Literature Review. Genes (Basel). 2022 Sep 27;13(10):1746. https://doi.org/10.3390/genes13101746.
18. Toumba M, Fanis P, Vlachakis D, et al. Molecular modelling of novel ADCY3 variant predicts a molecular target for tackling obesity. Int J Mol Med. 2022 Jan;49(1):10. https://doi.org/10.3892/ijmm.2021.5065.
19. Bernard A, Ojeda Naharros I, Yue X, et al. MRAP2 regulates energy homeostasis by promoting primary cilia localization of MC4R. JCI Insight. 2023 Jan 24;8(2):e155900. https://doi.org/10.1172/jci.insight.155900.
20. Castro-Barquero S, Ruiz-León AM, Sierra-Pérez M, Estruch R, Casas R. Dietary Strategies for Metabolic Syndrome: A Comprehensive Review. Nutrients. 2020 Sep 29;12(10):2983. https://doi.org/10.3390/nu12102983.
21. da Silva Rosa SC, Nayak N, Caymo AM, Gordon JW. Mechanisms of muscle insulin resistance and the cross-talk with liver and adipose tissue. Physiol Rep. 2020 Oct;8(19):e14607. https://doi.org/10.14814/phy2.14607.
22. Fahed G, Aoun L, Bou Zerdan M, et al. Metabolic Syndrome: Updates on Pathophysiology and Management in 2021. Int J Mol Sci. 2022 Jan 12;23(2):786. https://doi.org/10.3390/ijms23020786.
23. Cho Y, Lee SY. Useful Biomarkers of Metabolic Syndrome. Int J Environ Res Public Health. 2022 Nov 15;19(22):15003. https://doi.org/10.3390/ijerph192215003.
24. Танянский Д.А., Денисенко А.Д. Влияние адипонектина на обмен углеводов, липидов и липопротеинов: анализ сигнальных механизмов. Ожирение и метаболизм. 2021;18(2):103-111. https://doi.org/10.14341/omet12754
25. Кох Н.В., Шрайнер Е.В., Воронина Е.Н., и др. Изучение ассоциации полиморфных локусов rs5400 гена SLC2A2 (GLUT2) и rs4684677 гена GHRL с избыточной массой тела и предпочтением углеводов у детей дошкольного и младшего школьного возраста. Российский педиатрический журнал. 2021;2(1):20-27. https://doi.org/10.15690/rpj.v2i1.2189.
26. Морозова Т.Е., Воробьева О.В., Герцог А.А. Хронический болевой синдром и ожирение: ассоциации маркеров воспаления с характеристиками болевого синдрома. Лечащий Врач. 2023;(2):7-11. https://doi.org/10.51793/OS.2023.26.2.001.
27. Кузина И.А., Гончарова Е.В., Мартиросян Н.С. и др. Состояние гемостаза у женщин с ожирением и метаболическим синдромом. РМЖ. Медицинское обозрение. 2021;5(9):598-604. https://doi.org/10.32364/2587-6821-2021-5-9-598-604.
28. Karra P, Winn M, Pauleck S, et al. Metabolic dysfunction and obesityrelated cancer: Beyond obesity and metabolic syndrome. Obesity (Silver Spring). 2022 Jul;30(7):1323-1334. https://doi.org/10.1002/oby.23444.
29. Heyn GS, Corrêa LH, Magalhães KG. The Impact of Adipose TissueDerived miRNAs in Metabolic Syndrome, Obesity, and Cancer. Front Endocrinol (Lausanne). 2020 Oct 6;11:563816. https://doi.org/10.3389/fendo.2020.563816.
30. Обрезан А.Г., Щербакова Н.В. Патогенетические механизмы развития патологии миокарда у больных со злокачественными новообразованиями: современное состояние проблемы. Кардиология. 2020;60(2):142-154. https://doi.org/10.18087/cardio.2020.2.n985.
31. Ali Syeda Z, Langden SSS, Munkhzul C, et al. Regulatory Mechanism of MicroRNA Expression in Cancer. Int J Mol Sci. 2020 Mar 3;21(5):1723. https://doi.org/10.3390/ijms21051723.
32. Миронова О.Ю., Бердышева М.В., Елфимова Е.М. МикроРНК: взгляд клинициста на состояние проблемы. Часть 1. История вопроса. Евразийский кардиологический журнал. 2023;(1):100-107. https://doi.org/10.38109/2225-1685-2023-1-100-107.
Об авторах
К. Е. КалашниковаРоссия
Калашникова Кристина Евгеньевна — врач педиатр, ординатор первого года Факультета медицины и психологии В. Зельмана
Новосибирск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Е. В. Шрайнер
Россия
Шрайнер Евгения Владимировна — к. м. н., врач гастроэнтеролог, педиатр, доцент кафедры акушерства и гинекологии Факультета медицины и психологии В. Зельмана; н.с.
Новосибирск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. И. Быстрова
Россия
Быстрова Валерия Игоревна — студент Факультета медицины и психологии В. Зельмана
Новосибирск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Г. И. Лифшиц
Россия
Лифшиц Галина Израилевна — д. м. н., профессор кафедры внутренних болезней, Факультет медицины и психологии В. Зельмана; заведующая лабораторией персонализированной медицины
Новосибирск
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Что уже известно об этой теме?
- Метаболический синдром (МС) является глобальной проблемой здравоохранения, особенно в развитых странах. За последние 40 лет заболеваемость МС удвоилась, и сейчас им страдает около трети населения.
- Известно, что генетические мутации в генах, таких как MC4R, LEP, LEPR, PCSK1, ADCY3, POMC и MRAP2, связаны с развитием ожирения и МС. Эти гены участвуют в лептин-меланокортиновом сигнальном пути, регулирующем энергетический обмен.
- МС включает ожирение, артериальную гипертензию, дислипидемию и инсулинорезистентность. Эти состояния увеличивают риск сердечно-сосудистых заболеваний, диабета и онкологических заболеваний.
- Хроническое воспаление и дисфункция адипокинов (например, лептина и адипонектина) играют важную роль в развитии МС.
Что нового даёт статья?
- Статья подробно описывает роль конкретных генов (MC4R, LEP, LEPR, PCSK1, ADCY3, POMC, MRAP2) в развитии МС, включая их влияние на энергетический обмен и пищевое поведение.
- В статье подчёркивается, что МС увеличивает риск развития онкологических заболеваний, таких как рак пищевода, желудка, толстой кишки и других органов. Это связано с хроническим воспалением, окислительным стрессом и дисфункцией микроРНК.
- Статья акцентирует внимание на роли микроРНК в прогрессировании онкологических заболеваний у пациентов с МС, что открывает новые возможности для разработки противораковой терапии.
Как это может повлиять на клиническую практику в обозримом будущем?
- Понимание генетических факторов, способствующих развитию МС, может улучшить раннюю диагностику и профилактику заболевания. Врачи смогут использовать генетические маркеры для выявления пациентов с повышенным риском.
- Знание генетических предикторов МС позволит разрабатывать индивидуальные подходы к лечению, учитывая генетические особенности пациента.
- Понимание связи МС с онкогенезом может привести к разработке новых стратегий профилактики и лечения рака у пациентов с МС, включая использование микроРНК в качестве терапевтических мишеней.
- Внедрение новых знаний о генетических и молекулярных механизмах МС может помочь в разработке более эффективных методов контроля за состоянием пациентов, снижая риск осложнений, таких как сердечно-сосудистые заболевания и диабет.
Рецензия
Для цитирования:
Калашникова К.Е., Шрайнер Е.В., Быстрова В.И., Лифшиц Г.И. Генетические факторы, способствующие развитию метаболического синдрома. Фармакогенетика и фармакогеномика. 2024;(2):5-12. https://doi.org/10.37489/2588-0527-2024-2-5-12. EDN: USTDYY
For citation:
Kalashnikova C.E., Shrayner E.V., Bystrova V.I., Lifshits G.I. Genetic factors contributing to the development of metabolic syndrome. Pharmacogenetics and Pharmacogenomics. 2024;(2):5-12. (In Russ.) https://doi.org/10.37489/2588-0527-2024-2-5-12. EDN: USTDYY










































