Перейти к:
Роль ДНК-профилирования в прогнозировании антиконвульсант-индуцированного удлинения интервала QT
https://doi.org/10.37489/2588-0527-2022-1-37-52
Аннотация
Антиконвульсанты, или противоэпилептические препараты (ПЭП), широко применяются при различных неврологических и психиатрических заболеваниях и зачастую назначаются на длительный период. В связи с этим остро стоит вопрос их профиля безопасности, в том числе оценки риска развития угрожающих жизни состояний и нежелательных реакций (НР). С точки зрения персонализированной медицины важной является разработка междисциплинарного подхода к разработке новой стратегии персонализированного метода прог- нозирования ПЭП-индуцированного удлинения интервала QT как одной из наиболее прогностически неблагоприятной кардиологической НР (в т. ч. синдром внезапной смерти — СВС). Мы провели поиск в базах данных полнотекстовых публикаций за период с 2012 по 2022 год, по ключевым словам и их комбинациям. Нами обнаружены и систематизированы моногенные и мультифакторные формы синдрома удли- нённого интервала QT (LQTS) и гены-кандидаты, замедляющие метаболизм ПЭП в печени. Выявление аллелей риска однонуклеотидных вариантов (ОНВ) генов-кандидатов, предрасполагающих к развитию ПЭП-индуцированных LQTS и СВС, позволит скорректировать выбор и дозировку этих препаратов и предотвратить развитие НР, что улучшит качество жизни и поможет снизить риск СВС у больных с психи- ческими и неврологическими расстройствами.
Ключевые слова
Для цитирования:
Журавлёв Н.М., Шнайдер Н.А., Насырова Р.Ф. Роль ДНК-профилирования в прогнозировании антиконвульсант-индуцированного удлинения интервала QT. Фармакогенетика и фармакогеномика. 2022;(1):37-52. https://doi.org/10.37489/2588-0527-2022-1-37-52
For citation:
Zhuravlev N.M., Shnayder N.A., Nasyrova R.F. The role of DNA-profiling in predicting anticonvulsant-induced QT prolongation diseases based on pharmacogenetic aspects. Pharmacogenetics and Pharmacogenomics. 2022;(1):37-52. (In Russ.) https://doi.org/10.37489/2588-0527-2022-1-37-52
Введение / Introduction
Антиконвульсанты (противоэпилептические препараты) применяются не только при лечении эпилепсии [1][2], но и при лечении других заболеваний и синдромов, например таких как: синдром нейропатической боли [3], шизофрения (в качестве стабилизаторов настроения) [4], оланзапин-индуцированное увеличение массы тела [5], дисморфофобии и поведенческие нарушения при деменции [6]. Помимо вышеперечисленного, антиконвульсанты (преимущественно бензодиазепинового ряда) представляют интерес для наркологов и токсикологов, т. к. получили широкое распространение среди больных наркоманией [7].
В связи с широким применением антиконвульсантов в психиатрической и неврологической практике и необходимостью их длительного (зачастую хронического) применения при широком круге психических расстройств и неврологических заболеваний актуальным становится вопрос об их профиле безопасности, включая оценку риска развития жизнеугрожающих состояний — лекарственно-индуцированных нежелательных реакций (НР). Согласно действующим в Российской Федерации классификациям и законодательным актам [8][9], серьёзные НР психофармакотерапии подлежат регистрации [10]. Однако выполнение нормативных актов не всегда реализуется на практике. С одной стороны, это не позволяет оценить частоту встречаемости антиконвульсант-индуцированных НР в полной мере. С другой стороны, антиконвульсант-индуцированные НР со стороны сердечного ритма и проводимости могут развиться внезапно на фоне относительного благополучия. Наконец, прогнозирование, оценка риска, коррекция и регистрация антиконвульсант-индуцированных НР со стороны сердечного ритма и проводимости обусловлены схожестью механизма действия антиконвульсантов [11] (табл. 1) на ионные каналы, которые экспрессируются как в центральной нервной системе (ЦНС), так и в проводящей системе сердца.
Таблица 1
Механизм действия и эффект антиконвульсантов на интервал QT, сердечный ритм и проводимость [11]
Table 1
Mechanism of action and effect of anticonvulsants on QT interval, heart rate and conduction [11]


В связи с этим важной, с позиции бурно развивающейся в Российской Федерации [12] и за рубежом персонализированной медицины, является разработка междисциплинарного подхода с участием врачей различных специальностей (неврологов, психиатров, клинических фармакологов, генетиков, врачей функциональной диагностики и др.) и новой стратегии персонализированного подхода к прогнозированию антиконвульсант-индуцированного удлинения интервала QT как одной из наиболее прогностически неблагоприятной кардиологической НР [13].
Цель настоящего обзора — обновление знаний о роли генетического тестирования (ДНК-профилирования) в прогнозировании риска удлинения интервала QT при приёме антиконвульсантов первой и новых генераций.
Синдром удлинённого интервала QT / Long QT syndrome
Синдром удлинённого интервала QT (англ. long QT syndrome; LQTS) — это генетически детерминированное заболевание, при котором у большинства членов семьи наблюдается реполяризация желудочков сердца по данным электрокардиограммы (ЭКГ) в виде удлинения интервала QT. Этот синдром связан с повышенной склонностью к аритмогенным обморокам, с развитием полиморфной желудочковой тахикардии (фр., torsades de pointes; TdP) и синдрома внезапной смерти (СВС) [14][15].
Наличие отягощённого семейного анамнеза (СВС у ребёнка или молодого взрослого), а также обмороков, головокружения и эпизодов остановки сердца в анамнезе может быть характерно для LQTS. Обморок при LQTS, как правило, стремительный и неожиданный, что и отличает его от обычных вазовагальных и ортостатических форм обморока, при которых возникают пресинкопальные и другие предупреждающие симптомы. Отсутствие ауры, недержание мочи и постиктальные данные помогают отличить обмороки, связанные с LQTS, от эпилептических приступов [16].
В мире заболевание встречается относительно редко, с распространённостью примерно 1:3000–1:5000. Расстройство имеет переменную пенетрантность. Около 85 % зарегистрированных случаев передаются по наследству от одного из родителей, а у оставшихся 15 % пациентов наблюдаются мутации de novo [17]. Так, распространённость LQTS в Италии варьирует от 1/5000 до 1/20000. По данным итальянских учёных, распространённость LQTS у новорождённых составляла от 23 до 43 % [18]. LQTS выявлен во всех этнических группах [16]. Примерно у 10–15 % пациентов, которые умирают от осложнений LQTS, смерть является первым признаком данного расстройства [16].
Исследования из реестра LQTS, включая пациентов, лиц с патогенным вариантом (в основном леченных), а также родственников, которые внезапно умерли, показывают совокупную смертность в возрасте до 40 лет на уровне 6–8 % в LQTS типа 1, типа 2 и фенотипы типа 3 [17][19]. У лиц в возрасте от 0 до 18 лет с фенотипом LQTS 1, 2 или 3-го типов совокупная смертность составляет 2 %, 3 % и 7 % соответственно. В возрасте от 19 до 40 лет смертность составляет 5 %, 7 % и 5 % соответственно. Несмотря на то что синкопальные состояния наиболее распространены при фенотипе LQTS1 (63 %), за которым следуют фенотипы LQTS2 (46 %) и LQTS3 (18 %), частота летальных исходов одинакова во всех трёх случаях [16].
В исследовании с использованием метода генеалогического древа смертности изучалась смертность в больших семьях с LQTS, когда болезнь не была известна и пациенты не получали терапии, по сравнению со здоровыми людьми. По результатам данного иссле-дования, для фенотипа LQTS1 (один специфический патогенный вариант) было показано резко увеличивающаяся смертность в детском возрасте (1–19 лет), для фенотипа LQTS2 наблюдалась повышенная смертность в возрасте от 15 до 39 лет, а для LQTS3 наблюдалась повышенная смертность в возрасте от 15 до 19 лет [20].
Для подтверждения наличия у пациента LQTS необходимо провести электрокардиографию (ЭКГ). Тем не менее, данный метод не является специфичным в диагностике LQTS, так как примерно 25 % пациентов с LQTS, подтверждённым наличием однонуклеотидного варианта (ОНВ) в LQTS-ассоциированном гене, могут иметь нормальный диапазон QTc (скрытый LQTS) [21]. У здоровых людей средняя продолжительность QTc составляет примерно 400 мс. Верхний предел нормы составляет 460 мс для женщин и 450 мс для мужчин. Интервалы QTc более 520 мс, аутосомно-рецессивный тип наследования LQT1, пациенты с синдромом Джервелла и Ланге — Нильсона, синдромом Тимоти и те, у кого более 10 приступов аритмии до 18 лет, имеют экстремально высокий риск развития неблагоприятных сердечно-сосудистых событий [22].
Для дополнительной диагностики пациентов с «неопределёнными» значениями QTc на ЭКГ покоя используют следующие методы: ЭКГ с нагрузкой, которая обычно отображает неспособность интервала QTc нормально укорачиваться и даже удлинение интервала QTc [24–26], у многих людей развиваются характерные аномалии зубца T на ЭКГ [27]; измерение интервала QTc при переходе из положения лёжа на спине в положение стоя [28]; внутривенное фармакологическое провокационное тестирование (например, с адреналином), которое может быть полезным, демонстрируя несоответствующее удлинение интервала QTc [29] (учитывая небольшой риск индукции аритмии, такое провокационное тестирование лучше всего проводить в лабораториях, имеющих опыт индукции и контроля аритмии [30][31]); определение электромеханического окна при эхокардиографии (данное исследование представляет собой определение разницы между механической и электрической систолами [22]).
Schwartz PJ и соавт. (1993) предложили шкалу для диагностики LQTS по данным клинической картины [32]. В 2011 году шкала была пересмотрена Schwartz PJ и Crotti L. Баллы присваиваются по различным критериям [11][33].
Диагноз LQTS устанавливается у пробанда с одним или несколькими из следующих признаков [34]: 1) оценка риска ≥3,5 балла при отсутствии вторичной причины удлинения интервала QT; 2) наличие интервала QTс ≥500 мс на повторных ЭКГ при отсутствии вторичной причины удлинения QT; 3) идентификация ОНВ в одном из генов-кандидатов, которые связаны с LQTS.
Антиконвульсант-индуцированный синдром удлинённого интервала QT / Anticonvulsantinduced long QT syndrome
Классическая морфология ЭКГ покоя представлена тремя фазами: деполяризации, распространения возбуждения и реполяризации предсердий и желудочков. Зубец P и длительность интервала PQ отражают деполяризацию предсердий и атриовентрикулярную проводимость. Комплекс QRS отображает деполяризацию желудочков. Интервал QT показывает продолжительность реполяризации желудочков сердца. Клеточную электрическую основу ЭКГ составляют кардиомиоциты и возникающие в них потенциалы действия. Деполяризация (фаза 0) происходит за счёт быстрого притока положительно заряженных ионов натрия (INa) через натриевые каналы (SCN5A / Nav1.5). Последующая реполяризация состоит из 3 фаз: в фазе 1 после инактивации натриевых каналов возникает кратковременный, направленный наружу реполяризующий калиевый ток (IK); фаза 2 («фаза плато») характеризуется сбалансированными, деполяризующими, направленными внутрь кальциевыми токами через кальциевые каналы L-типа и противоположными, реполяризованными, направленными наружу калиевыми токами IKr (KCNH2 / HERG) и IKs (KCNQ1 / KvLQT1); в фазе 3 реполяризующие наружные калиевые токи (IKs, IKr и IK1) берут верх [11]. В целом, сердечная реполяризация кардиомиоцитов (и, следовательно, продолжительность QT) определяется сложным взаимодействием нескольких деполяризующих и реполяризующих ионных токов [35].
Многие антиконвульсанты изменяют активность ионных каналов. Например, фенитоин, карбамазепин и ламотриджин являются блокаторами INa-каналов (рис. 1). Исследования клеточной экспрессии показывают, что несколько антиконвульсантов блокируют быстрые калиевые каналы внутреннего выпрямления IKr, которые способствуют реполяризации потенциала действия в миокарде (табл. 1) [4].

Рис. 1. Влияние антиконвульсантов на ионные каналы [36]
Fig. 1. The effect of anticonvulsants on ion channels [36]
Факторы риска удлинения интервала QT у пациентов, получающих антиконвульсанты / Risk factors for prolongation of the QT interval in patients receiving anticonvulsants
Физиологическое удлинение интервала QT зарегистрировано во время сна (в начальную фазу эпизодов апноэ на протяжении сна [37]), а также в течение 60 мин после еды интервал QT увеличивался с 16 до 23 мс [38].
Можно предположить развитие антиконвульсант-индуцированного LQTS при подборе препарата у пациентов из следующих групп риска: ранний и молодой возраст (сердечные события могут происходить с младенчества до среднего возраста, но наиболее распространены в период с подросткового возраста до 20 лет) [16]; пожилой возраст (пациенты старше65 лет) [39]; женский пол (интервал QT длиннее в 2 раза, чем у мужчин, и в два раза выше риск антиконвульсант-индуцированной желудочковой тахиаритмии (TdP)) [39]; осложнения со стороны сердечно-сосудистой системы в анамнезе (гипертрофия миокарда, брадикардия) [39]; отягощённый семейный анамнез, врождённый LQTS [16][39]; электролитные нарушения (гипокалиемия, гипомагниемия) [39]; субарахноидальное кровоизлияние в анамнезе [16]; сахарный диабет в анамнезе [40]; повышенная концентрация гормонов щитовидной железы [40][41]; ожирение способствует удлинению интервала QT (причём при наборе веса на 10 кг выше нормы интервал увеличивался на > 5 мс) [42][43]; повышенный уровень холестерина в сыворотке крови [40][41]; одновременное использование препаратов, участвующих в одном метаболическом пути c антиконвульсантами через ферментную систему цитохрома P450 (CYP) 2D6, 1A2 и 3A4 [44]; приём препаратов, удлиняющих интервал QT [16]; высокие концентрации антиконвульсанта в крови [39]; одновременное использование двух и более блокаторов калиевых каналов IKr (например, эритромицин и пимозид) [44]; курение (последствия курения могут быть опосредованы увеличением адгезии тромбоцитов и высвобождением катехоламинов) [45]; употребле-ние кофеина [46]; зависимость от психоактивных веществ [47]; генетическая предрасположенность [48]; новая коронавирусная инфекция COVID-19 в анамнезе [49].
Существует гипотеза множественных попаданий, в которой говорится, что в редких случаях необходим только один фактор риска для развития НР, чаще всего требуется комбинация нескольких вышеперечисленных факторов [44].
Гены, ответственные за семейные формы синдрома удлинённого интервала QT / Genes responsible for familial forms of long QT syndrome
Несмотря на то что диагностика и ведение пациентов с семейными формами LQTS является сферой клинического интереса кардиологов, существует вероятность того, что пациент, страдающий неврологическими заболеваниями и психическими расстройствами, может быть носителем причинных генных мутаций, ответственных за семейные формы LQTS. Например, несмотря на низкую частоту наличия у пациента клинического фенотипа «эпилепсия + семейная форма LQTS», «шизофрения + семейная форма LQTS», помнить о такой вероятности неврологу и психиатру необходимо. Однако в настоящее время алгоритмы междисциплинарного подхода к ведению такого неблагоприятного в отношении СВС фенотипа не разработаны. В то же время по мере совершенствования молекулярно-генетической диагностики активно разрабатываются и внедряются в клиническую практику панели ДНК-профилирования пациентов с отягощённым семейным анамнезом по LQTS или случаям СВС. Поэтому неврологам и психиатрам перед назначением длительной терапии антиконвульсантами необходимо уточнять эти вопросы при сборе семейного анамнеза и анамнеза жизни пациента.
Важно знать о патогенных мутациях в генах KCNH2, KCNQ1 и SCN5A, ответственных за пода вляющее большинство случаев LQTS. У пациентов с патогенными (каузальными) мутациями этих генов чаще выделяют три клинических фенотипа: LQTS1, LQTS2 и LQTS3 [11][16].
С практической точки зрения, это является чрезвычайно важным, поскольку для развития моногенных форм LQTS минимально дополнительное влияние внешнесредовых факторов, к которым, в частности, относится приём антиконвульсантов, или их влияние менее значимо по сравнению с мультифакторными формами заболеваний. В связи с этим риск СВС у таких пациентов является высоким даже при монотерапии антиконвульсантами, влияющими на сердечный ритм и проводимость (см. табл. 1). Таким образом, назначения антиконвульсантов, влияющих на интервал QT, следует избегать (рис. 2) при лечении этой категории пациентов. Учитывая вышеописанное, перед назначением антиконвульсантов с высоким риском НР со стороны сердечного ритма и проводимости важным является уточнение личного и семейного анамнеза LQTS и, по показаниям, проведение ДНК-диагностики мутаций, ответственных за семейный LQTS, поскольку ЭКГ в ряде случаев не информативна.
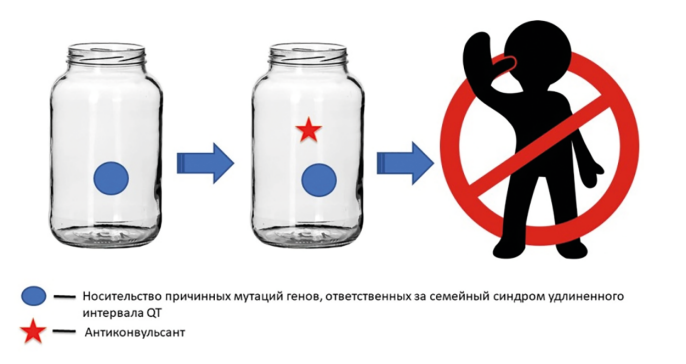
Рис. 2. Моногенные формы LQTS: назначение антиконвульсантов, влияющих на сердечный ритм
и проводимость, противопоказано из-за высокого риска синдрома внезапной смерти даже в режиме монотерапии
Fig. 2. Monogenic forms of LQTS: the appointment of anticonvulsants affecting heart rate and conduction
is contraindicated due to the high risk of sudden death syndrome, even in monotherapy
Кандидатные гены, ответственные за предрасположенность к удлинению интервала QT / Candidate genes responsible for predisposition to prolongation of the QT interval
В популяции в целом и среди пациентов с неврологическими заболеваниями и психическими расстройствами распространённость мультифакторных форм LQTS выше, чем моногенных.Такие формы ассоциированы с носительством однонуклеотидных вариантов (ОНВ) / полиморфизмов кандидатных генов, предрасполагающих к удлинению интервала QT при условии дополнительного воздействия внешнесредовых факторов, к которым, в частности, относится приём антиконвульсантов. Это обусловливает повышение числа ассоциативных генетических исследований ОНВ / полиморфизмов кандидатных генов, кодирующих ионные каналы, экспрессирующихся как в ЦНС, так и в проводящей системе сердца, поскольку выявление пациентов группы риска может помочь предотвратить развитие СВС при длительном приёме антиконвульсантов у пациентов неврологического и психиатрического профиля [11].
Ген HERG (локус LQTS2) локализован на хромосоме 7q35-36 и кодирует IKr. Мутации в гене HERG уменьшают ток ионов калия и, таким образом, удлиняют ПД [50]. По данным Khera AV и соавт. (2019), носительство ОНВ rs189014161 (p.Arg744Ter) гена HERG было ассоциировано с риском удлинения интервала QT [51].
Ген SCN5A локализован на хромосоме 3p22.2 и кодирует альфа-субъединицу сердечного потенциалзависимого натриевого канала 5-го типа. Этот ионный канал приводит к быстрому деполяризационному увеличению сердечного потенциала действия. Известно, что некоторые ОНВ гена SCN5A повышают риск развития СВС [52]. В исследовании Spellmann I и соавт. (2018) наблюдали значительное влияниемажорной (распространённой) аллели ОНВ rs1805124 (H558R) гена SCN5A на удлинение QTc. Представленные данные предполагают общую связь между H558R и продолжительностью интервала QT: гомозиготный генотип AA был связан с более коротким интервалом QT [53]. Gouas L и соавт. (2005) обнаружили ассоциацию между H558R и удлинением интервала QT у здоровых людей [54]. Носители аллеля G показали большую продолжительность интервала QT. Напротив, Hobday Р и соавт. (2006) не обнаружили такой связи в когорте пациентов с ССЗ [55]. Аналогичным образом Lehtinen АВ и соавт. (2009) не смогли обнаружить значительного влияния H558R на продолжительность интервала QT у пациентов с сахарным диабетом [56]. Однако Pfeufer А и соавт. (2009) не обнаружили значимости H558R в полногеномном анализе, но результаты предполагают, по крайней мере, небольшое независимое влияние на длительность QTc [57].
Ген KCNE1 / MIRP1 локализован на хромосоме 21q22 и кодирует IKs. Мутации в этом гене способствуют медленному открытию и быстрому закрытию калиевых каналов, тем самым уменьшая токи калия внутрь клетки. Некоторые ОНВ в гене KCNE1 предрасполагают к развитию антиконвульсант-индуцированного синдрома LQTS [58]. Альтернативные микровольтные зубцы T (TWA) на ЭКГ, характеризующиеся колебаниями амплитуды и морфологии зубца T между сердечными сокращениями, представляют собой электрофизиологическое явление, клинически связанное с желудочковыми аритмиями, и являются важным маркером риска аритмии. Koskela J и соавт. (2008) проверили гипотезу о том, влияют ли те же ОНВ, которые влияют на интервал QT, на вариацию TWA. Авторы изучали ассоциацию ОНВ rs1805127, rs727957 гена KCNE1 и rs1805124 гена SCN5A с вариабельностью TWA во время клинического теста с физической нагрузкой. В результате TWA был самым низким у пациентов — носителей гомозиготного генотипа TT (rs1805127) гена KCNE1 на всех этапах теста с физической нагрузкой. Результат оставался статистически значимым после поправки на возраст, ИБС в анамнезе и постоянный приём бета-блокаторов [59].
Ген AKAP9 / KCNQ1 локализован на хромосоме 7q21.2 и кодирует якорный белок альфа-киназы 9-го типа. AKAP9 образует макромолекулярный комплекс с α-субъединицами потенциал-зависимого калиевого канала, Kv7.1 (также известный как KCNQ1) и связанными с ним β-субъединицами (KCNE1), являющимися частью IKs [60]. Эта изоформа AKAP взаимодействует с KCNQ1 и способствует его фосфорилированию [61]. Однако она не только напрямую связывается и способствует фосфорилированию KCNQ1, но и сама фосфорилируется и способствует преобразованию вызванных фосфорилированием изменений в активность изменённых потенциалзависимых калиевых каналов. Carin P и соавт. (2015) рассматривали ассоциацию четырёх ОНВ (rs11772585, rs7808587, rs2282972 и rs2961024) гена AKAP9 с риском удлинения интервала QT. Выявлено, что носительство гомозиготного генотипа GG (rs2961024), которое чаще представлено гомозиготами по гаплотипу CGCG, приводит к удлинению интервала QT в зависимости от возраста пациента (плюс 1 % на каждые 10 лет) (p = 0,006). Аллель T (rs11772585), уникально обнаруженная в гаплотипе TACT, более чем в два раза увеличивает (218 %) риск НР со стороны сердечно-сосудистой системы (p = 0,002) у носителей генотипов риска ОНВ A341V. Кроме того, это усугубляло тяжесть заболевания (p = 0,025). Генотип GG (rs7808587) был связан с увеличением риска нарушений сердечного ритма на 74 % (p = 0,046), в то время как носительство аллели Т (rs2282972), преимущественно представленное гаплотипом CATT, снижало риск LQТS на 53 % (p = 0,001) [62].
Таким образом, ДНК-профилирование пациентов неврологического и психиатрического профилей с целью выявления носительства ОНВ кандидатных генов, предрасполагающих к мультифакторным формам LQTS, может помочь в определении пациентов группы риска, которым на фоне приёма антиконвульсантов в монотерапии и особенно в режиме политерапии требуется мониторинг ЭКГ и консультация кардиолога (по показаниям) в динамике (рис. 3).

Рис. 3. Мультифакторные формы LQTS: назначение антиконвульсантов, влияющих на сердечный
ритм и проводимость, возможно с осторожностью, желательно в режиме монотерапии, требуется
холтеровское мониторирование ЭКГ в динамике
Fig. 3. Multifactorial forms of LQTS: the appointment of anticonvulsants affecting heart rate and conduction
is possible with caution, preferably in monotherapy mode, Holter ECG monitoring in dynamics is required
Гены-кандидаты, ответственные за замедление метаболизма антиконвульсантов / Candidate genes responsible for slowing the metabolism of anticonvulsants
Большинство антиконвульсантов, применяемых в реальной клинической практике неврологов и психиатров, метаболизируются в печени с участием изоферментов цитохрома Р450. Выделяют 4 фенотипа метаболизма антиконвульсантов в зависимости от скорости их метаболизма: экстенсивный (extensive metabolizator — EM); промежуточный (intermediate metabolizator — IM); медленный (poor metabolizator — РМ); ультрабыстрый (ultrarapid metabolizator — URM) [63–66].
С позиции развития антиконвульсант-индуцированных НР наибольший клинический интерес представляют нефункциональные ОНВ/полиморфизмы генов, кодирующие изоферменты цитохрома Р450 печени. Гетерозиготные и гомозиготные (в большей мере) носители низкофункциональных и нефункциональных ОНВ имеют фенотип РМ, значительно сниженную скорость метаболизма антиконвульсантов с печёночным (или преимущественно печёночным) путём метаболизма и повышение уровня антиконвульсанта и/или его активного метаболита (метаболитов) в крови. Это объясняет высокий риск развития антиконвульсант-индуцированных НР, в том числе со стороны сердечно-сосудистой системы.
Клиническая ситуация может усугубиться тем, что пациент, нуждающийся в длительном приёме антиконвульсантов в моно- или политерапии, может быть как носителем ОНВ/полиморфизмов генов, ас-социированных с мультифакторным LQTS [11], так и носителем низкофункциональных или нефункциональных ОНВ/полиморфизмов генов, кодирующих изоферменты цитохрома Р450 печени (табл. 2). Такой вариант представляет собой наиболее сложную клиническую ситуацию, когда пациент с неврологическим заболеванием или психическим расстройством входит в группу кумулятивно высокого риска развития СВС и нуждается в междисциплинарном подходе к динамическому наблюдению неврологом, психиатром и кардиологом (терапевтом).
Таблица 2
Гены-кандидаты, ответственные за вторую фазу метаболизма антиконвульсантов в печени путём Р-окисления
Table 2
Candidate genes responsible for the second phase of liver anticonvulsant metabolism by P-oxidation



Рис. 4. Фенотип «медленный метаболизатор», предрасполагающий к повышению уровня антиконвульсантов в крови до токсического и развитию лекарственно-индуцированного удлинения интервала QT: назначение антиконвульсантов, влияющих на сердечный ритм и проводимость, возможно,
но с осторожностью, желательно в режиме монотерапии, требуется проведение терапевтического
лекарственного мониторинга в динамике
Fig. 4. Phenotype “poor metabolizer”, predisposing to an increase in the level of anticonvulsants in
the blood to toxic and the development of drug-induced prolongation of the QT interval: the appointment of
anticonvulsants affecting heart rate and conduction is possible, but with caution, preferably in monotherapy
mode, therapeutic drug monitoring is required in dynamics
С позиции персонализированной медицины, важной является разработка фармакогенетических панелей, позволяющих оценить кумулятивный риск развития антиконвульсант-индуцированного LQTS у рассматриваемой категории пациентов психоневрологического профиля.
Обсуждение / Discussion
В настоящее время практикующие неврологи и психиатры имеют большой выбор антиконвульсантов [65]. При назначении последних клиницист должен руководствоваться интересами пациента и безопасностью антиконвульсантов [66], что вынуждает специалистов учитывать как особенности механизма действия этих лекарственных средств, так и наличие или отсутствие носительства ОНВ / полиморфизмов генов, ассоциированных с высоким риском развития LQTS.
В целом, антиконвульсанты нельзя отнести к лекарственным средствам класса А (табл. 3) классификации, предложенной Fanoe S и соавт. в 2014 году [67], т. к. они вызывают удлинение интервала QT, либо об их влиянии на интервал QT нет данных. Это заставляет практикующих врачей с осторожностью относиться к длительному назначению антиконвульсантов и предполагать риск развития LQTS и, как следствие, возможный СВС (см. табл. 3) [2].
Таблица 3
Классификация психотропных лекарственных средств по риску удлинения интервала QT и развития аритмии [2][67]
Table 3
Classification of psychotropic drugs according to the risk of prolongation of the QT interval and the development of arrhythmia [2][67]

С риском антиконвульсант-индуцированного LQTS ассоциированы (рис. 5): гены, ответственные за семейные формы LQTS; гены-кандидаты, ответственные за развитие мультифакторных форм LQTS; гены-кандидаты, кодирующие ключевые ферменты метаболизма антиконвульсантов в печени (рис. 6). В связи с этим ДНК-профилирование является важным методом персонализированной стратегии психофармакотерапии и обеспечения безопасности антиконвульсантов, поскольку позволяет прогнозировать риск развития этой кардиологической НР на этапе выбора лекарственного средства и титрации его дозы.

Рис. 5. Генетические предикторы риска развития лекарственно-индуцированного удлинённого интервала QT
на фоне приёма антиконвульсантов
Fig. 5. Genetic predictors of the risk of drug-induced
prolonged QT interval while taking anticonvulsants

Рис. 6. Оценка кумулятивного риска лекарственно-индуцированного синдрома удлинения интервала QT на фоне применения антиконвульсантов включает носительство аллелей риска однонуклеотидных вариантов / полиморфизмов генов-кандидатов предрасположенности к развитию
мультифакторных форм LQTS и генов, кодирующих ключевые ферменты метаболизма антиконвульсантов в печени
Fig. 6. Assessment of the cumulative risk of drug-induced QT prolongation syndrome against the background
of anticonvulsant use includes the carriage of risk alleles of single-nucleotide variants/polymorphisms of
candidate genes predisposition to the development of multifactorial forms of LQTS and genes encoding key
enzymes of anticonvulsant metabolism in the liver
Заключение / Conclusion
Учитывая широкое применение антиконвульсантов в неврологической и психиатрической практике и высокую вероятность развития цереброкардиального синдрома и жизнеугрожающих антиконвульсант-индуцированных НР, персонализированный подход к назначению данной группы лекарственных средств имеет важное значение. Выявление аллелей риска ОНВ / полиморфизмов генов, предрасполагающих к развитию антиконвульсант-индуцированного LQTS, позволит корректировать выбор и дозировку лекарственного средства и предотвратить развитие аритмогенных НР, что поможет улучшить качество жизни пациентов и снизить риск гибели пациента с расстройством психоневрологического профиля. Помимо изложенного выше, предотвращение развития LQTS и, как следствие, СВС позволит улучшить качество оказания специализированной медицинской помощи и сохранит трудоспособное население.
Список литературы
1. Карлов В. А. Эпилепсия у детей и взрослых мужчин и женщин. М.: БИНОМ-Пресс, 2019. 896 с. [Karlov VA. Epilepsiya u detej i vzroslyh muzhchin i zhenshchin. Moscow: BINOM-Press, 2019. (In Russ).].
2. Шнайдер Н. А., Петрова М. М., Петров К. В., Насырова Р. Ф. Фармакологические предикторы нарушения сердечного ритма и проводимости при юношеской миоклонической эпилепсии. Эпилепсия и пароксизмальные состояния. 2021;13(2):168–79. [Shnayder NA, Petrova MM, Petrov KV, Nasyrova RF. Pharmacological predictors of heart rate and conductivity disorders in juvenile myoclonic epilepsy. Epilepsiya i paroksizmalʹnye sostoyania = Epilepsy and Paroxysmal Conditions. 2021;13(2):168–179. (In Russ).]. DOI: 10.17749/2077-8333/epi.par.con.2021.051
3. Бородулина И. В., Рачин А. П. Полинейропатии в практике врача: особенности патогенеза, клиники и современные подходы к лечению болевых и безболевых форм. РМЖ. 2016;25:1705–1710. [Borodulina IV, Rachin AP. Polyneuropathies: pathogenesis, clinical manifestations, and current treatment approaches to painful and painless conditions. RMJ. 2016;25:1705–1710. (In Russ).].
4. Auerbach DS, Biton Y, Polonsky B, McNitt S, Gross RA, Dirksen RT, Moss AJ. Risk of cardiac events in Long QT syndrome patients when taking antiseizure medications. Transl Res. 2018 Jan;191:81–92.e7. DOI: 10.1016/j.trsl.2017.10.002
5. Talaeı A, Farıdhosseını F, Kazemı H, Fayyazı Bordbar MR, Rezaeı Ardanı A. Topiramatın Şizofreni ve İki Uçlu Duygudurum I Bozukluğu Olan Hastalarda İlaca Bağlı Kilo Alımına Etkileri: Doz Ayarlarının Seçkisiz Klinik Çalışması. [Effect of Topiramate on Drug Associated Weight Gain of Patients with Schizophrenia and Bipolar I Disorders: A Dose Ranging Randomized Trial]. Turk Psikiyatri Derg. 2016 Summer;27(2):0. Turkish. PMID: 27370059.
6. Демьянов И. А., Сурикова В. В., Мельник Е. Ю. Современные тенденции использования антиконвульсантов в психиатрической практике. Вестник СПбГУ. Медицина. 2017;12(3):235–242. [Current trends in the use of anticonvulsants in psychiatric practice. Vestnik SPbSU. Medicine. 2017;12(3):235–242. (In Russ).]. DOI: 10.21638/11701/spbu11.2017.303
7. Brunetti P, Giorgetti R, Tagliabracci A, Huestis MA, Busardò FP. Designer Benzodiazepines: A Review of Toxicology and Public Health Risks. Pharmaceuticals (Basel). 2021 Jun 11;14(6):560. DOI: 10.3390/ph14060560
8. Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 11.06.2021) «Об обращении лекарственных средств». [Federal Law No. 61-FZ “Ob obrashchenii lekarstvennyh sredstv” dated 12.04.2010 (as amended on 11.06.2021). (In Russ).].
9. Приказ Росздравнадзора от 15.02.2017 № 1071 (ред. от 16.07.2020) «Об утверждении Порядка осуществления фармаконадзора». [Order of Roszdravnadzor No. 1071 “Ob utverzhdenii Poryadka osushchestvleniya farmakonadzora” dated 15.02.2017 (as amended on 16.07.2020) (In Russ).].
10. Бочанова Е. Н., Шнайдер Н. А., Дмитренко Д. В. и др. Опыт регистрации нежелательных побочных реакций на противоэпилептические препараты в клинике Красноярского медицинского университета. Врач. 2016;4:6–8. [Bochanova EN, Shnayder NA, Dmitrenko DV, et al. Experience in recording undesirable side effects from antiepileptic drugs in the Krasnoyarsk medical university clinic. VRACH. 2016;4:6–8. (In Russ).].
11. Zhuravlev NM, Shnayder NA, Vaiman EE, Abdyrakhmanova AK, Petrova MM, Bochanova EN, Romanova IV, Gavrilyuk OA, Lareva NV, Nasyrova RF. Interindividual Variability of Anticonvulsant-Induced QT Prolongation Risk. Personalized Psychiatry and Neurology. 2022;2(1):22–45. DOI: 10.52667/2712-9179-2022-2-1-23-45
12. Приказ Минздрава России от 01.02.2019 № 42 (ред. от 24.08.2020) «Об утверждении ведомственной целевой программы “Развитие фундаментальной, трансляционной и персонализированной медицины”». [Order of the Ministry of Health of Russia No. 42 “On approval of the departmental target program “Development of fundamental, translational and personalized medicine” dated 01.02.2019 (as amended on 24.08.2020). (In Russ).].
13. Салмина А. Б., Шнайдер Н. А., Михуткина С. В. Современные представления об ионных каналах и каналопатиях (обзор литературы). Сибирское медицинское обозрение.2005;34(1):75–78. [Salmina AB, Shnayder NA, Mikhutkina SV. Sovremennye predstavleniya ob ionnyh kanalah i kanalopatiyah (obzor literatury). Siberian Medical Review. 2005;34(1):75–78. (In Russ).].
14. Neira V, Enriquez A, Simpson C, Baranchuk A. Update on long QT syndrome. J Cardiovasc Electrophysiol. 2019 Dec;30(12):3068–3078. DOI: 10.1111/jce.14227
15. Nakano Y, Shimizu W. Genetics of long-QT syndrome. J Hum Genet. 2016;61(1):51–55. DOI: 10.1038/jhg.2015.74
16. Alders M, Bikker H, Christiaans I. Long QT Syndrome. 2003 Feb 20 [updated 2018 Feb 8]. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Mirzaa G, Amemiya A, editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993–2021. PMID: 20301308.
17. Goldenberg I, Zareba W, Moss AJ. Long QT Syndrome. Curr Probl Cardiol. 2008;33(11):629–694. DOI: 10.1016/j.cpcardiol.2008.07.002
18. Schwartz PJ, Crotti L, Insolia R. Long-QT syndrome: from genetics to management. Circ Arrhythm Electrophysiol. 2012;5(4):868–877. DOI: 10.1161/CIRCEP.111.962019. Erratum in: Circ Arrhythm Electrophysiol. 2012 Dec;5(6):e119–20. PMID: 22895603.
19. Zareba W, Moss AJ, Schwartz PJ, et al. Influence of the genotype on the clinical course of the long-QT syndrome. International Long-QT Syndrome Registry Research Group. N Engl J Med. 1998;339(14):960–965. DOI: 10.1056/NEJM199810013391404
20. Nannenberg EA, Sijbrands EJ, Dijksman LM, et al. Mortality of inherited arrhythmia syndromes: insight into their natural history. Circ Cardiovasc Genet. 2012;5(2):183–189. DOI: 10.1161/CIRCGENETICS.111.961102
21. Goldenberg I, Horr S, Moss AJ, et al. Risk for life-threatening cardiac events in patients with genotype-confirmed long-QT syndrome and normalrange corrected QT intervals. J Am Coll Cardiol. 2011;57(1):51–59. DOI: 10.1016/j.jacc.2010.07.038
22. Lankaputhra M, Voskoboinik A. Congenital Long QT Syndrome: A Clinician’s Guide. Internal Medicine Journal. 2021;51(12):1999–2011. DOI:10.1111/imj.15437
23. Committee For Proprietary Medicinal Products (CPMP) Points to consider: The assessment of the potential for QT interval prolongation by non-cardiovascular medicinal products. London: 1997 Dec.
24. Jervell A, Lange-Nielsen F. Congenital deaf-mutism, functional heart disease with prolongation of the Q-T interval and sudden death. Am Heart J. 1957;54(1):59–68. DOI: 10.1016/0002-8703(57)90079-0
25. Horner JM, Horner MM, Ackerman MJ. The diagnostic utility of recovery phase QTc during treadmill exercise stress testing in the evaluation of long QT syndrome. Heart Rhythm. 2011;8(11):1698–1704. DOI: 10.1016/j.hrthm.2011.05.018
26. Sy RW, van der Werf C, Chattha IS, et al. Derivation and validation of a simple exercise-based algorithm for prediction of genetic testing in relatives of LQTS probands. Circulation. 2011;124(20):2187–2194. DOI: 10.1161/CIRCULATIONAHA.111.028258
27. Zhang L, Timothy KW, Vincent GM, et al. Spectrum of ST-T-wave patterns and repolarization parameters in congenital long-QT syndrome: ECG findings identify genotypes. Circulation. 2000;102(23):2849–2855. DOI: 10.1161/01.cir.102.23.2849
28. Viskin S, Postema PG, Bhuiyan ZA, et al. The response of the QT interval to the brief tachycardia provoked by standing: a bedside test for diagnosing long QT syndrome. J Am Coll Cardiol. 2010;55(18):1955–1961. DOI: 10.1016/j.jacc.2009.12.015
29. Ackerman MJ, Khositseth A, Tester DJ, et al. Epinephrine-induced QT interval prolongation: a gene-specific paradoxical response in congenital long QT syndrome. Mayo Clin Proc. 2002;77(5):413–421. DOI: 10.4065/77.5.413
30. Shimizu W, Noda T, Takaki H, et al. Diagnostic value of epinephrine test for genotyping LQT1, LQT2, and LQT3 forms of congenital long QT syndrome. Heart Rhythm. 2004;1(3):276–283. DOI: 10.1016/j.hrthm.2004.04.021
31. Vyas H, Hejlik J, Ackerman MJ. Epinephrine QT stress testing in the evaluation of congenital long-QT syndrome: diagnostic accuracy of the paradoxical QT response. Circulation. 2006;113(11):1385–1392. DOI: 10.1161/CIRCULATIONAHA.105.600445
32. Schwartz PJ, Moss AJ, Vincent GM, Crampton RS. Diagnostic criteria for the long QT syndrome. An update. Circulation. 1993;88(2):782–784. DOI: 10.1161/01.cir.88.2.782
33. Schwartz PJ, Crotti L. QTc behavior during exercise and genetic testing for the long-QT syndrome. Circulation. 2011;124(20):2181–2184. DOI: 10.1161/CIRCULATIONAHA.111.062182
34. Priori SG, Wilde AA, Horie M, et al. HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes: document endorsed by HRS, EHRA, and APHRS in May 2013 and by ACCF, AHA, PACES, and AEPC in June 2013. Heart Rhythm. 2013;10(12):1932–1963. DOI: 10.1016/j.hrthm.2013.05.014
35. Castiglione A, Odening K. QT-Zeit — Was fange ich eigentlich damit an? [QT Interval and Its Prolongation — What Does It Mean?]. Dtsch Med Wochenschr. 2020 Apr;145(8):536–542. German. DOI: 10.1055/a-0969-6312
36. Эпилепсия и спорт: руководство для врачей / под ред. Н. А. Шнайдер, М. М. Петровой, Р. Ф. Насыровой, О. В. Балберовой. СПб.: ДЕАН, 2022. 248 с. ISBN 978-5-6048707-0-9. [Epilepsy and sport: a guide for physicians. Ed by Shnayder NA, Petrova MM, Nasyrova RF, Balberova OV. Saint-Petersburg: DEAN; 2022. (In Russ).].
37. Parks KA, Parks CG, Yost JP, et al. Acute blood pressure changes associated with antipsychotic administration to psychiatric inpatients. Prim Care Companion CNS Disord. 2018;20(4):18m02299. DOI: 10.4088/PCC.18m02299
38. Nagy D, DeMeersman R, Gallagher D, et al. QTc interval (cardiac repolarisation): Lengthening after meals. Obes Res. 1997;5:531–537. DOI: 10.1002/j.1550-8528.1997.tb00573.x
39. Wenzel-Seifert K, Wittmann M, Haen E. QTc prolongation by psychotropic drugs and the risk of Torsade de Pointes. Dtsch Arztebl Int. 2011;108(41):687–693. DOI: 10.3238/arztebl.2011.0687
40. Brown DW, Giles WH, Greenlund KJ et al. Impaired fasting glucose, diabetes mellitus, and cardiovascular disease risk factors are associated with prolonged QTc duration. Results from the Third National Health and Nutrition Examination Survey. J Cardiovasc Risk. 2001;8(4):227–233. DOI: 10.1177/174182670100800407
41. van Noord C, Eijgelsheim M, Stricker BH. Drug- and non-drugassociated QT interval prolongation. Br J Clin Pharmacol. 2010;70(1):16–23. DOI: 10.1111/j.1365-2125.2010.03660.x
42. Carella MJ, Mantz SL, Rovner DR, et al. Obesity, adiposity, and lengthening of the QT interval: improvement after loss. Int J Obes Relat Metab Disord. 1996;20(10):938–942. PMID: 8910099.
43. El-Gamal A, Gallagher D, Nawras A, et al. Effects of obesity on QT, RR, and QTc intervals. Am J Cardiol.1995:75(14):956–959. DOI: 10.1016/s0002-9149(99)80700-0
44. Zareba W, Lin DA. Antipsychotic drugs and QT interval prolongation. Psychiatr Q. 2003;74(3):291–306. DOI: 10.1023/a:102412270633745. Zipes DP, Wellens HJJ. Sudden cardiac death. Circulation. 1998;98:233451.
45. Shah AA, Aftab A, Coverdale J. QTc prolongation with antipsychotics: is routine ECG monitoring recommended? J Psychiatr Pract. 2014;20(3):196– 206. DOI: 10.1097/01.pra.0000450319.21859.6d
46. Joukamaa M, Heliövaara M, Knekt P, et al. Schizophrenia, neuroleptic medication and mortality. Br J Psychiatry. 2006;188(2):122–127. DOI: 10.1192/bjp.188.2.122
47. Escande D. Pharmacogenetics of cardiac K(+) channels. Eur J Pharmacol. 2000;410(2-3):281–287. DOI: 10.1016/s0014-2999(00)00821-9
48. Varkey JN, Frishman WH. Arrhythmogenesis and COVID-19. Cardiol Rev. 2021;29(6):289–291. DOI: 10.1097/CRD.0000000000000407
49. Vincent GM. The molecular genetics of the long QT syndrome: genes causing fainting and sudden death. Annu Rev Med. 1998;49:263–274. DOI: 10.1146/annurev.med.49.1.263
50. Khera AV, Mason-Suares Н, Brockman D, et al. Rare Genetic Variants Associated With Sudden Cardiac Death in Adults. J Am Coll Cardiol. 2019;74(21):2623–2634. DOI: 10.1016/j.jacc.2019.08.1060
51. Chen L, Zhang W, Fang C et al. Polymorphism H558R in the human cardiac sodium channel SCN5A gene is associated with atrial fibrillation. J Int Med Res. 2011;39(5):1908–1916. DOI: 10.1177/147323001103900535
52. Spellmann I, Reinhard MA, Veverka D, et al. QTc prolongation in short-term treatment of schizophrenia patients: effects of different antipsychotics and genetic factors. Eur Arch Psychiatry Clin Neurosci. 2018;268(4):383–390. DOI: 10.1007/s00406-018-0880-8
53. Gouas L, Nicaud V, Berthet M et al. Association of KCNQ1, KCNE1, KCNH2 and SCN5A polymorphisms with QTc interval length in a healthy population. Eur J Hum Genet. 2005;13(11):1213–1222. DOI: 10.1038/sj.ejhg.5201489
54. Hobday P, Mahoney D, Urban L, et al. Influence of the common H558R-SCN5A sodium channel polymorphism on the electrocardiographic phenotype in a population-based study. Heart Rhythm. 2005;3:S279–S280. DOI: doi.org/10.1016/j.hrthm.2006.02.837
55. Lehtinen AB, Daniel KR, Shah SA, et al. Relationship between genetic variants in myocardial sodium and potassium channel genes and QT interval duration in diabetics: the Diabetes Heart Study. Ann Noninvasive Electrocardiol. 2009;14(1):72–79. DOI: 10.1111/j.1542-474X.2008.00276.x
56. Pfeufer A, Sanna S, Arking DE, et al. Common variants at ten loci modulate the QT interval duration in the QTSCD Study. Nat Genet. 2009;41(4):407–414. DOI: 10.1038/ng.362
57. Chiang CE, Roden DM. The long QT syndromes: genetic basis and clinical implications. J Am Coll Cardiol. 2000;36(1):1–12. DOI: 10.1016/s0735-1097(00)00716-6
58. Koskela J, Kähönen М, Fan М, et al. Effect of common KCNE1 and SCN5A ion channel gene variants on T-wave alternans, a marker of cardiac repolarization, during clinical exercise stress test: the Finnish Cardiovascular Study. Transl Res. 2008;152(2):49–58. DOI: 10.1016/j.trsl.2008.06.003
59. Barhanin J, Lesage F, Guillemare E, et al. KvLQT1 and IsK (minK) proteins associate to form the IKS cardiac potassium current. Nature. 1996;384:78–80. DOI: 10.1038/384078a0
60. Marx SO, Kurokawa J, Reiken S, Motoike H, D’Armiento J, Marks AR, Kass RS. Requirement of a macromolecular signaling complex for beta adrenergic receptor modulation of the KCNQ1-KCNE1 potassium channel. Science. 2002 Jan 18;295(5554):496–499. DOI: 10.1126/science.1066843
61. De Villiers CP, van der Merwe L, Crotti L et al. AKAP9 is a genetic modifier of congenital long-QT syndrome type 1. Circ Cardiovasc Genet. 2014;7(5):599–606. DOI: 10.1161/CIRCGENETICS.113.000580
62. Клиническая психофармакогенетика / под ред. Р. Ф. Насыровой, Н. Г. Незнанова.СПб.: ДЕАН, 2020. 408 с. [Clinical psychopharmacogenetics. Ed by Nasyrova RF, Neznanov NG. Saint-Petersburg: DEAN; 2020. (In Russ).].
63. Balestrini S, Sisodiya Sanjay M. Pharmacogenomics in epilepsy. Neuroscience Letters. 2021;29(6):289–291. DOI: 10.1016/j.neulet.2017.01.014
64. Остроумова О. Д., Голобородова И. В. Влияние отдельных групп лекарственных препаратов на риск удлинения интервала QTс. Consilium Medicum. 2019;21(10):95–106. [Ostroumova OD, Goloborodova IV. The effect of individual groups of drugs on the risk of prolongation of the QTc interval. Consilium Medicum. 2019;21(10):95–106. (In Russ).]. DOI: 10.26442/20751753.2019.10.190447
65. Neznanov NG. A paradigm shift to treat psychoneurological disorders. Personalized Psychiatry and Neurology. 2021;1(1):1–2.
66. Fanoe S, Kristensen D, Fink-Jensen A, et al. Risk of arrhythmia induced by psychotropic medications: a proposal for clinical management. Eur Heart J. 2014;35(20):1306–1315. DOI: 10.1093/eurheartj/ehu100
Об авторах
Н. М. ЖуравлёвРоссия
психиатр, м. н. с. Института персонализированной психиатрии и неврологии
Санкт-Петербург
Н. А. Шнайдер
Россия
невролог, д. м. н., профессор, в. н. с., заместитель руководителя Института персонализированной психиатрии и неврологии
Санкт-Петербург
в. н. с. Центра коллективного пользования «Молекулярные и клеточные технологии»
Красноярск
Р. Ф. Насырова
Россия
психиатр, д. м. н., гл. н. с., руководитель Института персонализированной психиатрии и неврологии
Санкт-Петербург
Рецензия
Для цитирования:
Журавлёв Н.М., Шнайдер Н.А., Насырова Р.Ф. Роль ДНК-профилирования в прогнозировании антиконвульсант-индуцированного удлинения интервала QT. Фармакогенетика и фармакогеномика. 2022;(1):37-52. https://doi.org/10.37489/2588-0527-2022-1-37-52
For citation:
Zhuravlev N.M., Shnayder N.A., Nasyrova R.F. The role of DNA-profiling in predicting anticonvulsant-induced QT prolongation diseases based on pharmacogenetic aspects. Pharmacogenetics and Pharmacogenomics. 2022;(1):37-52. (In Russ.) https://doi.org/10.37489/2588-0527-2022-1-37-52










































