Перейти к:
Первая фаза метаболизма антипсихотиков в печени: роль окисления
https://doi.org/10.37489/2588-0527-2022-1-15-30
Аннотация
В данной статье обсуждаются вопросы, освещающие роль метаболизма антипсихотиков (АП) в печени. Различают три фазы метаболизма АП. Цитохром Р450 монооксигеназа, оксидаза со смешанными функциями, играет ключевую роль в метаболизме большинства АП, участвуя в его первой фазе. Функциональная активность изоферментов цитохрома Р450 зависит от носительства однонуклеотидных вариантов (ОНВ) генов, кодирующих эти изоферменты, а также от межлекарственных взаимодействий. Функциональная активность изоферментов цитохрома Р450 может влиять на эффективность и безопасность применения АП. Практикующему врачу-психиатру важно знать пути окисления АП для предотвращения нежелательных реакций (НР) и нежелательных межлекарственных взаимодействий, что впоследствии повысит эффективность и безопасность терапии АП.
Для цитирования:
Шнайдер Н.А., Хасанова А.К., Насырова Р.Ф. Первая фаза метаболизма антипсихотиков в печени: роль окисления. Фармакогенетика и фармакогеномика. 2022;(1):15-30. https://doi.org/10.37489/2588-0527-2022-1-15-30
For citation:
Shnayder N.A., Khasanova A.K., Nasyrova R.F. First phase of antipsychotic metabolism in the liver: the role of oxidation. Pharmacogenetics and Pharmacogenomics. 2022;(1):15-30. (In Russ.) https://doi.org/10.37489/2588-0527-2022-1-15-30
Введение / Introduction
Антипсихотики (АП) представляют собой класс психотропных препаратов, которые в основном используются для лечения психозов и других психотических расстройств [1][2]. Этот класс лекарственных средств (ЛС), наряду со стабилизаторами настроения, также относится к ЛС первой линии терапии биполярного аффективного расстройства [3]. АП первого поколения (АПП), также известные как типичные нейролептики, имеют выраженный потенциал вызывать неврологические нежелательные реакции (НР), в первую очередь экстрапирамидные расстройства (акатизию, острые дистонические реакции, позднюю дискинезию, псевдопаркинсонизм и др.) [4]. АП второго поколения (АВП), также известные как атипичные нейролептики, в меньшей степени индуцируют экстрапирамидные НР [5][6], хотя их лучшая безопасность по сравнению с АПП дискутабельна в связи с риском индуцирования, например метаболических, НР.
Большинство АП претерпевают биотрансформацию или метаболизируются после того, как они попадают в организм и до выведения [7]. В ходе биотрансформации АП превращаются в более водорастворимые активные и неактивные метаболиты, которые впоследствии выводятся из организма. В процессе биотрансформации зачастую образуются более полярные или заряженные метаболиты, чем исходные АП, что увеличивает скорость клиренса и снижает скорость реабсорбции в почечных канальцах [8]. В ходе биотрансформации АП обычно становятся менее фармакологически активными или полностью неактивными соединениями, однако новообразованные метаболиты могут быть столь же фармакологически активными и даже более активными соединениями, если исходный АП был пролекарством. Метаболиты АП также могут оказывать токсическое действие на различные органы и ткани [9].
Реакции биотрансформации АП часто проходят несколько последовательных стадий с участием ферментов и ферментных систем. Большинство АП подвергаются биотрансформации в печени. Также некоторые АП метаболизируются в других органах и тканях [10].
Процесс биотрансформации АП вариабелен, что зависит от многих факторов, включая:
- пищевой статус;
- гормональный статус;
- генетические факторы (генетическая предрасположенность);
- предыдущая терапия АП или другими классами ЛС;
- сопутствующий соматический, неврологический и психический статус (например, наличие заболеваний сердечно-сосудистой и дыхательной систем может снижать скорость биотрансформации АП);
- возраст пациента (например, пациенты пожилого возраста или дети часто имеют большую чувствительность к АП, отчасти из-за инволюционного или незрелого состояния ферментных систем гепатоцитов, посредством которых метаболизируются АП);
- функциональное состояние печени [11].
Выделяют три фазы биотрансформации АП: I фаза (модификация); фаза II (конъюгация); фаза III (экскреция). Примечательно, что фазы I и II могут как быть последовательными, так и проходить в обратном порядке или одновременно, как единая реакция [12].
Цель / Aim
Обновить знания практикующего врача о роли цитохрома Р450 в метаболизме АП на основе анализа и обобщения результатов современных исследований изоферментов цитохрома Р450 (СYP1A1, СYP1A2, СYP2A6, СYP2C8, СYP2C9, СYP2C18, СYP2C19, СYP2D6, СYP2E1, СYP3A4, СYP3A5, СYP3A7, СYP3A43) в зависимости от их влияния на изменение скорости окисления АП первой и новых генераций.
Материалы и методы / Materials and methods
Был произведён поиск и анализ полнотекстовых публикаций на русском и английском языках в базах данных E-Library, PubMed, Springer, Scopus, Web of Science Core Collection, с использованием ключевых слов и комбинированных поисков слов (антипсихотик-индуцированные нежелательные реакции, психофармакотерапия, антипсихотики, нейролептики, типичные антипсихотики, атипичные антипсихотики, изоферменты, цитохром Р450, патофизиология, патогенез, однонуклеотидный вариант, диагностика, фармакогенетическое тестирование, фармакогенетика, лечение), за последнее десятилетие (2011–2021 гг.). Кроме того, в обзор включались более ранние публикации, имеющие исторический интерес. Несмотря на всесторонний поиск по этим часто используемым базам данных и поисковым терминам, нельзя исключать, что некоторые публикации могли быть пропущены.
Результаты / Results
Фаза I метаболизма антипсихотиков в печени и её клиническая роль / Phase I of antipsychotic metabolism in the liver and its clinical role
В результате реакций I фазы метаболизма исходные АП в печени обычно становятся менее активными. Следует отметить, что, когда образующиеся метаболиты после реакций I фазы становятся достаточно полярными, они могут быть немедленно выведены из организма человека. В противном случае образовавшиеся метаболиты соединяются с новыми функциональными группами, вследствие чего образуются более полярные и, следовательно, более водорастворимыеактивные метаболиты путём демаскирования или введения полярной функциональной группы (–OH, –SH, –NH2), обеспечивающей следующие стадии биотрансформации [13].
АП, метаболизирующиеся в реакциях фазы I, имеют более длительный период полувыведения. У пациентов гериатрического профиля I фаза метаболизма АП замедлена; они метаболизируют АП преимущественно реакциями II фазы и имеют более высокий риск развития АП-индуцированных НР. Однако, в целом, I фаза метаболизма АП играет важную роль в достижении баланса между безопасностью и эффективностью АП [12][14].
Реакции фазы I включают:
- окисление;
- гидролиз;
- редукцию.
В этих реакциях для последующего сопряжения к остатку метаболитов АП добавляются функциональные группы. Образуются метаболиты АП, которые затем становятся активным центром в реакциях II фазы [15]. Ферментные реакции, катализирующие биотрансформацию этой фазы, в основном происходят в системе цитохрома Р450 [16, 17]. Реакции окисления, которые происходят с участием изоферментов цитохрома Р450, происходят в гладком эндоплазматическом ретикулуме (ЭПР) гепатоцитов. В этих реакциях участвуют цитохром Р450 редуктаза, восстановленный никотинамидадениндинуклеотидфосфат (НАДФН) и кислород (О2 ). Изоферменты цитохрома Р450 также лучше метаболизируют ЛС с высокой растворимостью в жирах [17].
Система Р450 участвует во многих реакциях, например:
- деалкилирование;
- дезаминирование;
- сульфоксидирование;
- окисление [18].
НАДФН-цитохром Р450 редуктаза катализирует восстановительные реакции преимущественно в ЭПР или цитозоле клетки. Являясь мембраносвязанным ферментом, он переносит электроны от НАДФН к белкам гема и белкам системы Р450, включая гемоксигеназу от флавинадениндинуклеотида (ФАД) и флавинмононуклеотида (ФМН) — содержащего фермент НАДФН-цитохром Р450 редуктазу [19].
Схема электронного потока: НАДФН → ФАД → ФМН → P450 → O2
В реакциях восстановления вещество получает свободнорадикальный электрон, а затем теряет его взамен на кислород, и образуется супероксидный анион [20]. Гидролитическая реакция — реакция фазы I, в которой присоединяется молекула воды с разрывом прежних химических связей, в ЭПР эта реакция не происходит [21].
Важнейшую роль в метаболизме большинства АП играют монооксигеназы семейства цитохрома Р450 (оксидазы со смешанными функциями) [22]. Отдельные изоферменты этой системы участвуют в биотрансформации определённых АП, имея уникальную субстратную специфичность. Эта специфичность может частично совпадать у разных изоферментов системы Р450 [23].
В настоящее время известно не менее 50 различных изоферментов цитохрома Р450, но примерно 12 из них обеспечивают биотрансформацию большинства ЛС. Как сказано выше, семейство цитохрома Р450 катализирует реакции I фазы. Номенклатура: номер семейства указывается сразу, после этого термин CYP арабской цифрой, подсемейство именуется заглавной буквой латинского алфавита, а вторая арабская цифра после буквы указывает на конкретный изофермент в подсемействе. В результате обозначение изофермента имеет следующий вид: CYP2D6, CYP3A4, CYP3A5 и др. [24].
CYP2D6, CYP3A4, CYP3A5, CYP2C9 и CYP2C19 обеспечивают наибольшую часть функциональной активности (более 50 %) системы цитохрома Р450; эти изоферменты преобладают среди изоферментов печени и участвуют в метаболизме большинства ЛС, включая АП [25].
Изоферменты цитохрома Р450, как правило, обладают одним типом активности и функциями, которые достаточно разнообразны. Кроме того, они отличаются типами ферментативной активности, зачастую обладают малой субстратной специфичностью. Они могут проявлять как монооксигеназную, так и оксигеназную активность, поэтому иногда относятся к оксидазам со смешанной функцией [26]. Цитохром Р450 участвует в различных реакциях, например, катализирует деалкилирование по азоту, сере и кислороду; катализирует ароматическое и алифатическое гидроксилирование; катализирует восстановление по азоту; гидролиз сложных эфиров и амидов; окисление азота и серы. Изоферменты системы Р450, преимущественно, экспрессируются в печени, но также (в меньшей мере) и в других органах и тканях человеческого организма — например, в тонком и толстом кишечнике, яичках или яичниках, двенадцатиперстной кишке, поджелудочной железе, почках, селезёнке, лимфатических узлах и т. д. [27].
На клеточном уровне изоферменты семейства Р450 локализованы либо в ЭПР, либо в цитозоле, либо на внутренней митохондриальной мембране, и их каталитические центры обращены в сторону внеклеточного матрикса [17].
Фаза I метаболизма АП включает окислительную и восстановительную реакции. Синтез НАДФН зависит от редуктазы цитохрома Р450. Кофактор НАДФН участвует в восстановлении кислорода до воды в общей реакции окисления АП.
Ниже представлена реакция ароматического гидроксилирования [28]:
Антипсихотик + O2 + НАДФН + Н+ → Антипсихотик-ОН + НАДФ+ + Н2О
Активность изоферментов цитохрома Р450 вариабельна и зависит, среди прочего, от межлекарственного взаимодействия, поскольку АП и другие ЛС могут модулировать работу определённых ферментативных путей системы цитохрома Р450. Таким образом, может измениться метаболизм одновременно принимаемых ЛС. Все ЛС, в том числе АП, можно разделить на три группы, относящиеся к системе цитохрома Р450: субстраты, индукторы и ингибиторы этой системы [29].
Субстраты — это ЛС, метаболизирующиеся под действием изоферментов системы цитохрома Р450 [30].
Ингибиторы Р450 — это ЛС, подавляющие биотрансформацию других ЛС, метаболизирующихся посредством определённого изофермента цитохрома Р450.
Существует 2 вида ингибирования. Конкурентное ингибирование — это ингибирование, при котором ЛС конкурируют за изофермент цитохрома Р450, когда есть структурное сходство между субстратом и ингибитором на молекулярном уровне. Конкурентный ингибитор связывается с активным центром изофермента вместо субстрата, таким образом меньшее количество субстрата связывается с этим изоферментом. Когда ингибитор и субстрат имеют разные молекулярные структуры, ингибитор присоединяется к изоферменту и изменяет его структуру и активный центр, тем самым замедляя реакцию между этим изоферментом и субстратом [31]. Ингибирование (снижение скорости окисления АП) повышает терапевтическую концентрацию АП в крови (опасность токсичности) [32]. Существует большое количество ингибиторов среди разных групп ЛС — например, АП (галоперидол, оланзапин, клозапин и др.), антидепрессанты (АД) (флувоксамин, кломипрамин, дулоксетин и др.), противоэпилептические препараты (вальпроевая кислота, фенитоин, топирамат и др.), ЛС для лечения соматических заболеваний (изониазид, циметидин, кетоконазол, флуконазол и др.) [33], острое злоупотребление алкоголем и грейпфрутовый сок [31].
Индукторы цитохрома Р450 увеличивают функциональную активность изоферментов in vivo. Этот процесс связан с активацией синтеза этих изоферментов и снижает терапевтическую концентрацию АП в крови. Снижение концентрации АП может происходить за счёт индукции изоферментов цитохрома Р450, так как метаболизм АП, катализируемый определённым изоферментом, ускоряется, как и метаболизм самого индуктора, если он метаболизируется теми же изоферментами цитохрома Р450 [34]. Значительное количество ЛС являются индукторами различных изоферментов цитохрома Р450, что обусловливает межлекарственные взаимодействия, например АП (клозапин, хлорпромазин и др.), противоэпилептические препараты (фенитоин, карбамазепин, топирамат и др.), ЛС для лечения соматических заболеваний (гризеофульвин, троглитазон, омепразол, зверобой и др.), хроническое злоупотребление алкоголем, агенты окружающей среды, такие как табачный дым [31][33][35].
Некоторые клинически значимые изоферменты цитохрома Р450, например CYP2C9 и CYP2D6, высокополиморфны и имеют вариабельную ферментативную активность, что обусловлено носительством нефункциональных, низкофункциональных или высокофункциональных однонуклеотидных вариантов (ОНВ) генов CYP2C9 и CYP2D6 соответственно. Частота носительства этих ОНВ у представителей различных раз и этносов может значительно варьировать. Поскольку генетически детерминированные различия в функциональной активности изоферментов цитохрома Р450 влияет на скорость метаболизма АП в печени в I фазе (окисление), то это необходимо учитывать при выборе АП и тактики титрации разовой и суточной доз [36–38].
В зависимости от функциональной активности изоферментов цитохрома Р450 и скорости I фазы метаболизма (окисления) АП в печени пациентов можно разделить на 4 фенотипа: медленные метаболизаторы; промежуточные метаболизаторы; экстенсивные (распространённые) метаболизаторы; ультрабыстрые метаболизаторы [39][40].
Медленные метаболизаторы — это пациенты со значительно сниженной скоростью биотрансформации определённых АП в печени. Обычно такие пациенты являются гомозиготами по нефункциональному или низкофункциональному ОНВ/полиморфизму того или иного гена, кодирующего изофермент биотрансформации АП. У таких пациентов отсутствует или неактивен соответствующий изофермент цитохрома Р450. Соответственно, у медленных метаболизаторов АП с печёночным или преимущественно печёночным путём метаболизма лекарства, которые изначально являются активными соединениями, накапливаются в организме в высоких концентрациях, что приводит к появлению серьёзных НР, вплоть до острой и хронической интоксикации. Поэтому для пациентов с фармакогенетическим профилем «медленный метаболизатор» желательно заменить применяемый АП на АП с альтернативным путём метаболизма или осуществлять осторожный подбор дозы принимаемого АП под контролем терапевтического лекарственного мониторинга (ТЛМ) его уровня в крови. При этом стартовая и целевая дозы АП, метаболизирующегося с участием низкофункционального или нефункционального изофермента, должна быть не менее чем на ≈ 50 % ниже, чем средняя терапевтическая доза (согласно инструкции к данному ЛС) для пациентов с фармакогенетическим профилем «экстенсивный (распространённый) метаболизатор» [39–42].
Если АП является пролекарством (т. е. действует не сам АП, а его активный метаболит, образующийся из этого исходного АП в ходе биотрансформации в печени путём окисления с участием изоферментов семейства Р450), то у медленных метаболизаторов образуется меньше активного метаболита. Это может привести к низкой эффективности или неэффективности этого АП. Таким пациентам требуется увеличение дозы принимаемого АП-пролекарства или применение других АП-пролекарств, биотрансформация которых не зависит от данного изофермента. К таким АП-пролекарствам относятся: арипипразол, лауроксил, флуфеназин и др. [39][40].
Промежуточные метаболизаторы — пациенты со сниженной скоростью биотрансформации АП с печёночным или преимущественно печёночным путём метаболизма. Обычно такие пациенты являются гетерозиготами по нефункциональному или низкофункциональному варианту гена, кодирующего тот или иной изофермент цитохрома Р450 печени. У таких пациентов происходит синтез «дефектного» изофермента или значительное снижение синтеза нормального изофермента, в результате чего его ферментативная активность снижается. Соответственно, у промежуточных метаболизаторов АП, которые изначально являются активными соединениями, накапливаются в организме, что приводит к появлению НР. Поэтому для пациентов с фармакогенетическим профилем «промежуточный метаболизатор» должен быть осуществлён осторожный подбор дозы АП, которая должна быть меньше на ≈ 25–30 % от стандартной дозы (согласно действующей инструкции к данному ЛС), чем для пациентов с фармакогенетическим профилем «экстенсивный (распространённый) метаболизатор» [39][40][43][44].
Экстенсивные (распространённые) метаболизаторы — это пациенты с нормальной скоростью биотрансформации АП в печени. Такие пациенты являются гомозиготами по полнофункциональному (нормальному) варианту гена, кодирующего тот или иной изофермент цитохрома Р450. Соответственно, у экстенсивных метаболизаторов риск развития АП-индуцированных НР среднепопуляционный (минимальный) [39][40][45].
Сверхактивные, или быстрые, метаболизаторы — это пациенты с повышенной скоростью биотрансформации АП с печёночным или преимущественно печёночным путём метаболизма. К этому фенотипу приводит носительство высокофункциональных вариантов генов, кодирующих изоферменты семейства цитохрома Р450. Дупликации (удвоения) или мультипликации (умножения) функционально нормальных аллелей также могут приводить к формированию фармакогенетического профиля быстрого метаболизатора. У этой категории пациентов регистрируют низкие значения сывороточных концентраций АП при рекомендованных средних (или даже высоких) суточных дозах. Следствие этого — недостаточная для достижения терапевтического эффекта концентрация АП в крови. Для пациентов с фармакогенетическим профилем быстрого метаболизатора доза АП должна быть выше, чем у экстенсивных (распространённых) метаболизаторов. В этом случае назначается максимально допустимая доза АП (согласно инструкции к этому ЛС) или необходимо выбирать АП, в метаболизме которого не принимает участие данный изофермент. Наоборот, в случае, если АП является пролекарством, то у пациентов с фармакогенетическим профилем «быстрый метаболизатор» образуется больше активного метаболита (метаболитов) принимаемого АП, что может привести к развитию НР из-за высоких значений концентрации активного метаболита этого АП в крови. Поэтому быстрым метаболизаторам необходима меньшая доза АП-пролекарства, или от таких АП необходимо отказаться, если позволяет клиническая ситуация [39][40][46].
Оценка генетически детерминированного изменения скорости окисления АП в течение I фазы метаболизма и персонализированного риска развития АП-индуцированных НР существенно улучшает существующую в настоящее время классическую стратегию психофармакотерапии и объясняет важность разработки новых фармакогенетических панелей и их внедрения в реальную клиническую психиатрическую практику [39][40][47].
Ключевые изоферменты цитохрома Р450, участвующие в окислении антипсихотиков / Key cytochrome P450 isoenzymes involved in the oxidation of antipsychotics
У человека выявлено 57 генов и более 5 псевдогенов, кодирующих изоферменты цитохрома Р450. Эти изоферменты подразделяются на 18 семейств и 43 подсемейства [48].
Наиболее изучены и клинически значимы 13 изоферментов цитохрома Р450, участвующие в окислении АП: СYP1A1, СYP1A2, СYP2A6, СYP2C8, СYP2C9, СYP2C18, СYP2C19, СYP2D6, СYP2E1, СYP3A4, СYP3A5, СYP3A7, СYP3A43 [26][30][33].
В случае генетически детерминированного снижения функциональной активности или экспрессии (синтеза) этих изоферментов метаболизм АП нарушается в различной степени выраженности (снижается значительно, незначительно или умеренно). Это, в свою очередь, приводит к повышению времени экспозиции в крови, органах и тканях этого АП у медленных и промежуточных метаболизаторов, повышению риска кумуляции при хронической (длительной) психофармакотерапии и повышению риска развития серьёзных НР [39][40].
Изофермент CYP1A1 / CYP1A1 isoenzyme
Изофермент 1A1 цитохрома P450 (CYP1A1) — это изофермент, который у человека кодируется геном CYP1A1 [49]. CYP1A1 экспрессируется в мозжечке, коре головного мозга, гиппокампе, щитовидной железе, паращитовидных железах, надпочечниках, бронхахлёгких, тканях носоглотки, слизистой оболочке полости рта, желудке, двенадцатиперстной кишке, прямой кишке, печени, желчном пузыре, поджелудочной железе, почках, мочевом пузыре, яичниках, яичках, придатках яичка, эндометрии, плаценте, миндалинах, слюнных железах, пищеводе, простате, фаллопиевых трубах, шейке матки, груди, сердечной мышце, коже, селезёнке, лимфатических узлах (рис. 1) [50].
Изофермент CYP1A1 участвует в фазе I метаболизма ксенобиотиков и ЛС. CYP1A1 отвечает за метаболическую активацию проканцерогенов (полициклических ароматических углеводородов (ПАУ) и ароматических аминов) в реактивные метаболиты. Он также участвует в метаболизме стероидных гормонов, включая эстрогены. Предполагается, что уровень индуцируемости CYP1A1 может быть важным маркером риска рака лёгкого, так как большая часть пациентов с раком лёгкого демонстрирует более высокий фенотип индуцируемости, чем контрольные пациенты [51].
Изофермент CYP1A1 участвует в метаболизме следующих АП: галоперидол, пероспирон. Клозапин является индуктором данного изофермента (рис. 1) [33].
Изофермент CYP1A2 / CYP1A2 isoenzyme
Изофермент 1A2 цитохрома P450 (CYP1A2) у человека кодируется геном CYP1A2 [49]. Изофермент CYP1A2 экспрессируется преимущественно в печени (см. рис. 1) [50].
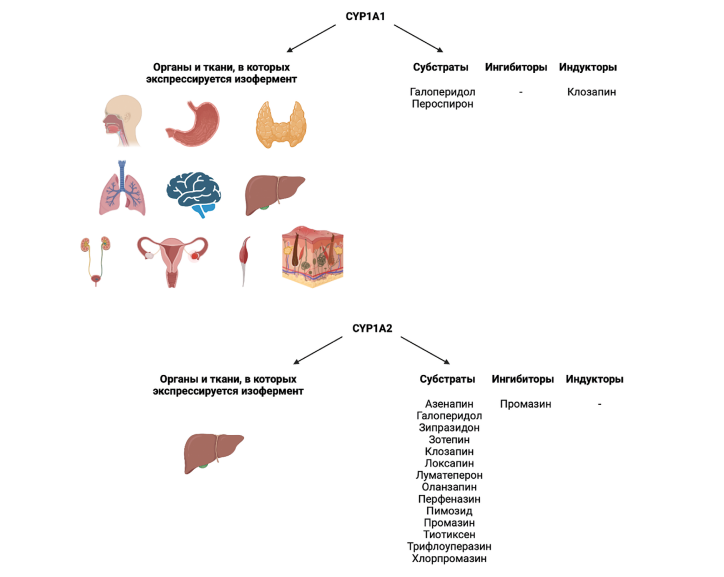
Рис. 1. Субстратная специфичность в отношении антипсихотиков и экспрессия
в органах и тканях изоферментов СYP1A1 и СYP1A2
Fig. 1. Substrate specificity for antipsychotics and expression in organs and tissues of
the isoenzymes СYP1A1 and СYP1A2
Изофермент CYP1A2 локализуется в ЭПР гепатоцитов, и его экспрессия индуцируется некоторыми полициклическими ароматическими углеводородами ПАУ, некоторые из которых содержатся в сигаретном дыме. Эндогенный субстрат этого изофермента неизвестен, однако он способен метаболизировать некоторые ПАУ до канцерогенных промежуточных продуктов. Другие ксенобиотические субстраты для этого изофермента включают кофеин, афлатоксин B1 и парацетамол [52].
Изофермент CYP1A2 также в значительной мере участвует в метаболизме полиненасыщенных жирных кислот в сигнальные молекулы, которые обладают как физиологической, так и патологической активностью. Он метаболизирует арахидоновую кислоту, докозагексаеновую, эйкозапентаеновую кислоты [52]. Изофермент CYP1A2 связан с 72 реакциями в10 различных подсистемах: цитозоль, внеклеточная, митохондрия, ядро, пероксисома [53].
Изофермент CYP1А2 участвует в метаболизме следующих АП: зотепин, промазин, трифлоуперазин, галоперидол (частично) азенапин (преимущественно), клозапин (преимущественно), луматеперон (частично), оланзапин (преимущественно), зипразидон (частично), хлорпромазин (частично), локсапин (частично), перфеназин (частично), пимозид (частично), тиотиксен (частично); промазин (ингибитор) (см. рис. 1) [33].
Изофермент CYP2A6 / CYP2A6 isoenzyme
Изофермент 2А6 цитохрома P450 (CYP2А6) у человека кодируется геном CYP2А6 [49]. CYP2А6 экспрессируется в печени, семенниках (рис. 2) [50].
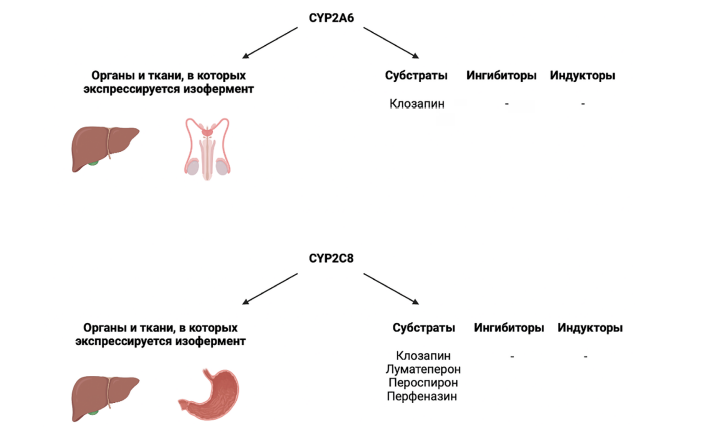
Рис. 2. Субстратная специфичность в отношении антипсихотиков и экспрессия
в органах и тканях изоферментов СYP2A6 и СYP2С8
Fig. 2. Substrate specificity for antipsychotics and expression in organs and tissues of
the isoenzymes СYP2A6 and СYP2С8
Изофермент CYP2A6 — это основной изофермент, ответственный за окисление никотина и котинина. Он также участвует в метаболизме нескольких ЛС: канцерогенов и ряда алкалоидов кумаринового типа. CYP2A6 — это единственный изофермент семейства цитохрома Р450 в организме человека, который в значительной степени катализирует 7-гидроксилирование кумарина. CYP2A6 локализуется в ЭПР клеток. Известно, что изофермент CYP2A6 индуцируется фенобарбиталом и рифампицином, и предполагается, что другие противоэпилептические препараты, кроме фенобарбитала, могут также иметь такой эффект [54].
Изофермент CYP2А6 участвует в метаболизме следующих АП: клозапин (рис. 2) [33].
Изофермент CYP2C8 / CYP2C8 isoenzyme
Изофермент 2С8 цитохрома P450 (CYP2С8) у человека кодируется геном CYP2С8 [49]. Изофермент CYP2С8 экспрессируется в печени и желудочно-кишечном тракте (рис. 2) [50].
Цитохром CYP2C8 обладает активностью эпоксигеназы: метаболизирует длинноцепочечные полиненасыщенные жирные кислоты (арахидоновую кислоту, эйкозапентаеновую кислоту, докозагексаеновую кислоту и линолевую кислоту до их биологически активных эпоксидов, которые действуют как сигнальные агенты) [55].
Изофермент CYP2С8 участвует в метаболизме следующих АП: клозапин, луматеперон (частично), пероспирон, перфеназин (см. рис. 2) [33].
Изофермент CYP2C9 / CYP2C9 isoenzyme
Изофермент 2С9 цитохрома P450 (CYP2С9) у человека кодируется геном CYP2C9. Изофермент CYP2С9 экспрессируется в печени, в меньшей степени — в двенадцатиперстной кишке, тонкой кишке, желудке, желчном пузыре (рис. 3) [50].
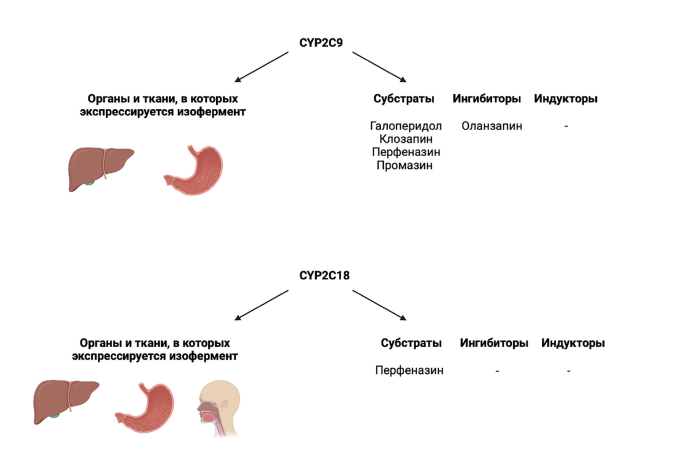
Рис. 3. Субстратная специфичность в отношении антипсихотиков и экспрессия в
органах и тканях изоферментов СYP2С9 и СYP2С18
Fig. 3. Substrate specificity for antipsychotics and expression in organs and tissues of the
isoenzymes СYP2С9 and СYP2С18
CYP2C9 — это изофермент цитохрома P450, который играет важную роль в окислении как ксенобиотиков, так и эндогенных соединений. CYP2C9 составляет около 18 % изоферментов цитохрома P450 в микросомах печени. Около 100 ЛC метаболизируются с участием CYP2C9, включая ЛС с узким терапевтическим индексом, например варфарин и фенитоинаценокумарол, толбутамид, лозартан, глипизид и некоторые нестероидные противовоспалительные препараты. Внепечёночный CYP2C9 участвует в метаболизме важных эндогенных соединений, таких как серотонин, также обладает эпоксигеназной активностью [56]. Кроме того, CYP2C9 метаболизирует арахидоновую кислоту, докозагексаеновую кислоту, эйкозапентаеновую кислоту [57].
Изофермент CYP2С9 участвует в метаболизме следующих АП: галоперидол, клозапин (частично), перфеназин (частично), промазин; оланзапин (ингибитор) (см. рис. 3) [33].
Изофермент CYP2C18 / CYP2C18 isoenzyme
Изофермент 2С18 цитохрома P450 (CYP2С18) у человека кодируется геном CYP2С18 [49]. Изофермент CYP2С18 экспрессируется в печени, проксимальном отделе желудочно-кишечного тракта, желудке (рис. 3) [50].
Изофермент CYP2C18 обладает активностью эпоксигеназы. Он метаболизирует арахидоновую кислоту, линолевую кислоту и 12,13-эпоксиоктадекаеновую кислоту, докозагексаеновую кислоту [58]. Изофермент CYP2С18 участвует в метаболизме следующих АП: перфеназин (см. рис. 3) [33]. Изофермент CYP2C19 / CYP2C19 isoenzyme Изофермент 2С19 цитохрома P450 (CYP2С19) у человека кодируется геном CYP2С19 [49]. Изофермент CYP2С19 экспрессируется в печени, двенадцатиперстной кишке (рис. 4) [50]. CYP2C19 — это печёночный изофермент, который участвует в метаболизме как минимум 10 % ЛC, используемых в настоящее время в клинической практике: в первую очередь, антиагрегантов (клопидогрела), ингибиторов протонной помпы (омепразола и др.), антиконвульсантов (вальпроаты и др.), противомалярийных и анксиолитических ЛС. Изоферменты подсемейства CYP2C, включая CYP2C19, составляют примерно 20 % цитохрома P450 в печени взрослого человека. CYP2C19 также обладает активностью эпоксигеназы [59].
Изофермент CYP2С19 участвует в метаболизме следующих АП: галоперидол, кветиапин, клозапин (частично), перфеназин (частично), пипотиазин, промазин, рисперидон, тиоридазин (частично); оланзапин (ингибитор), клозапин (ингибитор), рисперидон (ингибитор) (см. рис. 4) [33].
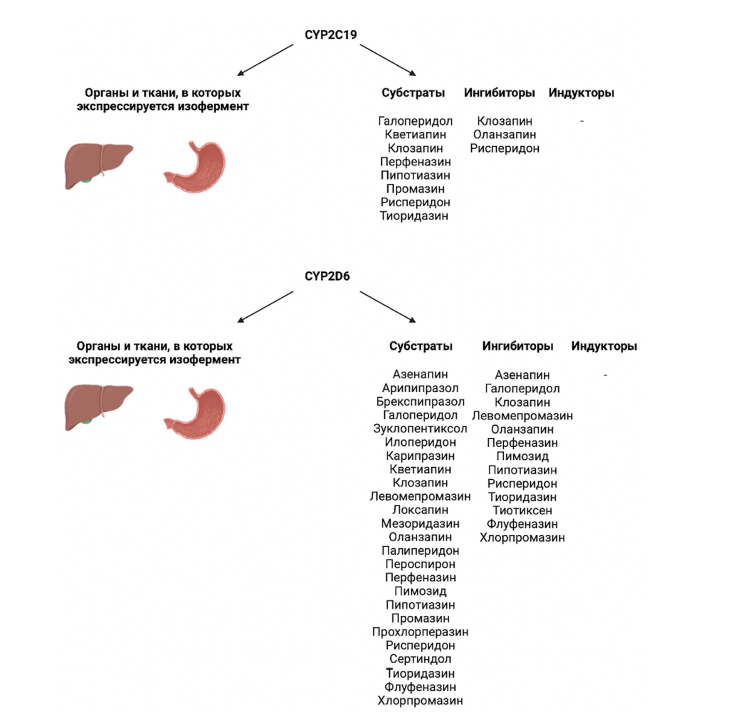
Рис. 4. Субстратная специфичность в отношении антипсихотиков и экспрессия в
органах и тканях изоферментов CYP2С19 и CYP2D6
Fig. 4. Substrate specificity for antipsychotics and expression in organs and tissues of the
isoenzymes CYP2C19 and CYP2D6
Изофермент CYP2D6
Изофермент 2D6 цитохрома P450 (CYP2D6) у человека кодируется геном CYP2D6 [49]. Изофермент CYP2D6, в первую очередь, экспрессируется в печени, в меньшей степени — в желудочно-кишечном тракте (рис. 4) [50]. Изофермент CYP2D6, член системы смешанной оксидазы цитохрома P450, является одним из наиболееважных изоферментов, участвующих в метаболизме ксенобиотиков в организме в целом и широкого круга АП в частности. Этот изофермент отвечает за метаболизм и выведение примерно 25 % используемых в клинической практике ЛС путём добавления или удаления определённых функциональных групп в результате процессов гидроксилирования, деметилирования и деалкилирования. CYP2D6 также активирует некоторые пролекарства. Этот изофермент также метаболизирует несколько эндогенных веществ, таких как гидрокситриптамины, нейростероиды, а также м-тирамин и p-тирамин, которые изофермент CYP2D6 метаболизирует в дофамин в гепатоцитах и нейронах [60].
Изофермент CYP2D6 участвует в метаболизме следующих АП: азенапин (частично), галоперидол (преимущественно), кветиапин (частично), клозапин (частично), левомепромазин, мезоридазин, оланзапин (частично), палиперидон, пероспирон, перфеназин (преимущественно), пипотиазин, промазин, прохлорперазин, рисперидон (преимущественно), сертиндол, тиоридазин (преимущественно), хлорпромазин (частично), арипипразол (преимущественно), брекспипразол (преимущественно), карипразин (частично), илоперидон (преимущественно), флуфеназин (частично), локсапин (частично), пимозид (преимущественно), зуклопентиксол (преимущественно); галоперидол (ингибитор), оланзапин (ингибитор),азенапин (ингибитор), клозапин (ингибитор), перфеназин (ингибитор), пимозид (ингибитор), тиоридазин (умеренный ингибитор), тиотиксен (ингибитор), хлорпромазин (ингибитор), пипотиазин (ингибитор), левомепромазин (ингибитор), рисперидон (ингибитор), флуфеназин (ингибитор) (рис. 4) [33].
Изофермент CYP2E1 / CYP2E1 isoenzyme
Изофермент 2E1 цитохрома P450 (CYP2E1) у человека кодируется геном CYP2E1 [49]. Изофермент CYP2E1 экспрессируется в печени (рис. 5) [50].
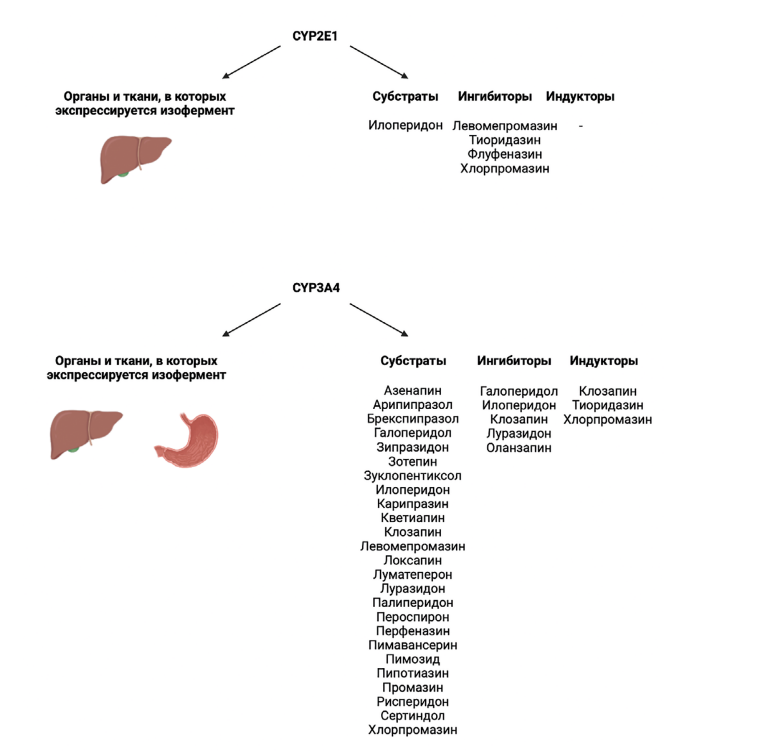
Рис. 5. Субстратная специфичность в отношении антипсихотиков и экспрессия в органах и
тканях изоферментов CYP2Е1 и CYP3A4
Fig. 5. Substrate specificity for antipsychotics and expression in organs and tissues of CYP2E1 and
CYP3A4 isoenzymes
CYP2E1 метаболизирует менее 5 % наиболее часто назначаемых ЛС, играет важную роль в определении их токсичности. CYP2E1 является преобладающим изоферментом в семействе CYP2E и составляет примерно 7 % от общего содержания цитохрома Р450 у взрослых. CYP2E1 также участвует в превращении этанола в ацетальдегид и в ацетат. В последовательности преобразования ацетил-кофермент А (ацетил-КоА) в глюкозу CYP2E1 трансформирует ацетон в пропиленгликоль и метилглиоксаль, предшественники пирувата, ацетата и лактата. CYP2E1 также осуществляет метаболизм эндогенных жирных кислот, он также имеет эпоксигеназную активность [61].
Изофермент CYP2E1 участвует в метаболизме следующих АП: илоперидон, тиоридазин (ингибитор), хлорпромазин (ингибитор), левомепромазин (ингибитор), флуфеназин (ингибитор) (рис. 5) [33].
Изофермент CYP3A4 / CYP3A4 isoenzyme
Изофермент 3А4 цитохрома P450 (CYP3А4) у человека кодируется геном CYP3А4 [49]. Изофермент CYP3А4 экспрессируется преимущественно в печени, двенадцатиперстной кишке и тонком кишечнике (рис. 5) [50].
Это один из наиболее важных изоферментов, участвующих в метаболизме ксенобиотиков и ЛС в организме человека. Его целью является окисление чужеродных органических молекул. CYP3A4 является одним из большой группы изоферментов цитохрома Р450 печени. Этот белок локализуется в ЭПР гепатоцитов. CYP3A4 участвует в метаболизме приблизительно половины используемых ЛС, включая парацетамол, кодеин, циклоспорин, диазепам, эритромицин и широкий круг АП. Кроме этого, этот изофермент метаболизирует некоторые стероиды и канцерогены [62].
Изофермент CYP3А4 участвует в метаболизме следующих АП: азенапин (частично), кветиапин (преимущественно), клозапин (преимущественно), луматеперон (преимущественно), луразидон (преимущественно), палиперидон (частично), пероспирон, перфеназин (частично), пимозид (преимущественно), пипотиазин, промазин, рисперидон (преимущественно), сертиндол, илоперидон (преимущественно), галоперидол (преимущественно), арипипразол (преимущественно), брекспипразол (преимущественно), карипразин (преимущественно), пимавансерин (преимущественно), зипразидон (частично), хлорпромазин (частично), локсапин (частично), левомепромазин (частично), зотепин, зуклопентиксол (частично); илоперидон (слабый ингибитор), луразидон (слабый ингибитор), галоперидол (ингибитор), оланзапин (ингибитор), клозапин (ингибитор); клозапин (индуктор), хлорпромазин (индуктор), тиоридазин (слабый индуктор) (рис. 5) [33].
Изофермент CYP3A5 / CYP3A5 isoenzyme
Изофермент 3А5 цитохрома P450 (CYP3А5) у человека кодируется геном CYP3А5 [49]. Изофермент CYP3А5 экспрессируется в печени, тонком кишечнике, желудке, двенадцатиперстной кишке, поджелудочной железе (рис. 6) [50].
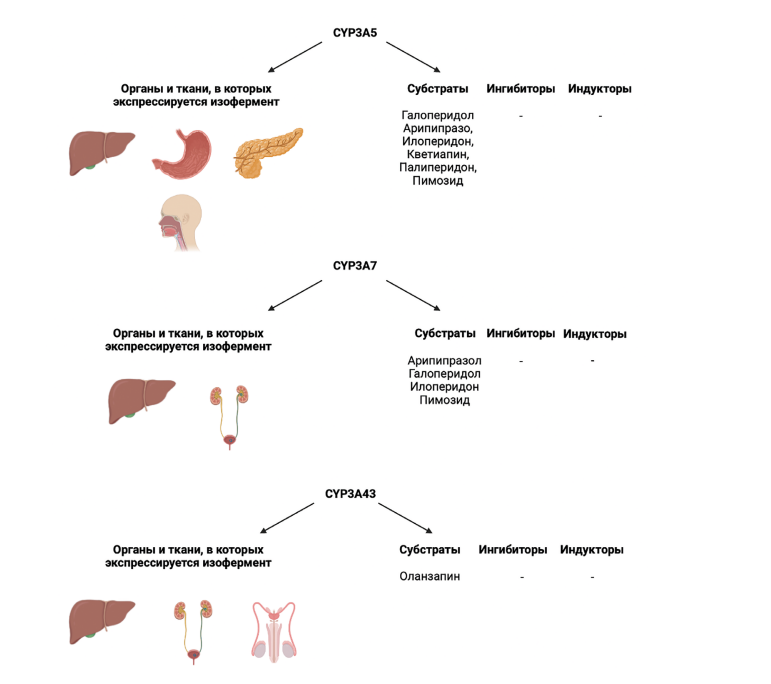
Рис. 6. Субстратная специфичность в отношении антипсихотиков и экспрессия в органах и тканях изоферментов CYP3А5, CYP3А7 и CYP3A43
Fig. 6. Substrate specificity for antipsychotics and expression in organs and tissues of
isoenzymes CYP3A5, CYP3A7 and CYP3A43
Этот изофермент локализуется в ЭПР гепатоцитов, и его экспрессия индуцируется глюкокортикоидами и некоторыми АП. Изофермент метаболизирует такие ЛС, как нифедипин и циклоспорин, а также стероидные гормоны (тестостерон, прогестерон и андростендион). CYP3А5 участвует в НАДФН-зависимом пути транспорта электронов. CYP3A5 окисляет стероиды, жирные кислоты и ксенобиотики. Подсемейство CYP3A человека (CYP3A4, CYP3A5, CYP3A7 и CYP3A43) является одной из наиболее универсальных систем биотрансформации, которые участвуют в метаболизме широкого круга ЛС (37 % из 200 наиболее часто назначаемых ЛС в США). CYP3A4 и CYP3A5 вместе составляют примерно 30 % печёночного цитохрома P450, и примерно половина ЛС, которые окислительно метаболизируются P450, являются субстратами CYP3A [63].
Изофермент CYP3А5 участвует в метаболизме следующих АП: галоперидол, арипипразол, илоперидон, кветиапин, палиперидон, пимозид (рис. 6) [33].
Изофермент CYP3A7 / CYP3A7 isoenzyme
Изофермент 3А7 цитохрома P450 (CYP3А7) у человека кодируется геном CYP3А7 [49]. Изофермент CYP3А7 экспрессируется преимущественно в печени, в меньшей мере — почках и мочевом пузыре (рис. 6) [50].
Этот изофермент состоит из 503 аминокислот и имеет 87 % своей последовательности с изоферментом CYP3A4. Он выполняет ту же роль у плода, что и CYP3A4 у взрослых. Группа изоферментов CYP3A является наиболее широко экспрессируемой группой цитохрома P450 в печени. Они участвуют в метаболизме более 50 % всех ЛС [64]. Изофермент CYP3А7 участвует в метаболизме следующих АП: арипипразол, галоперидол, илоперидон, пимозид (рис. 6) [33].
Изофермент CYP3A43 / Isoenzyme CYP3A43
Изофермент 3A43 цитохрома P450 (CYP3A43) — это изофермент, который у человека кодируется геном CYP3A43 [49]. Изофермент CYP3A43 экспрессируется преимущественно в печени, в меньшей мере — почках, семенниках (рис. 6) [50].
Этот изофермент имеет низкий уровень активности тестостерон-гидроксилазы. Хотя он имеет гомологию с некоторыми цитохромами Р450, метаболизирующими ЛС, неизвестно, участвует ли этот изофермент также в метаболизме ксенобиотиков [65].
Известно, что изофермент CYP3A43 участвует в метаболизме оланзапина (рис. 6) [33].
Обсуждение / Discussion
Перспективы трансляции результатов фундаментальных исследований окисления антипсихотиков в реальную клиническую практику / Prospects for the translation of the results of fundamental research on the oxidation of antipsychotics into real clinical practice
Как упоминалось выше, для практикующего психиатра чрезвычайно важно знать пути окисления АП, так как большинство из них метаболизируется в печени. Это важно как для предотвращения и минимизации НР, так и для предотвращения нежелательных межлекарственных взаимодействий при сочетанном приёме психотропных препаратов. Безусловно, эти знания смогут повысить безопасность терапии расстройств шизофренического спектра [66].
Фармакогенетическое тестирование (ФГТ) — это диагностический метод для идентификации генотипов по ОНВ/полиморфизмам генов, ассоциированных с изменением фармакологического ответа и/или развитием НР [67][68]. Метод ФГТ позволяет оценить риск генетически детерминированного изменения функциональной активности и экспрессии рассмотренных выше изоферментов цитохрома Р450, участвующих в окислении широкого круга АП первой и новых генераций с печёночным и преимущественно печёночным путём метаболизма. ФГТ способствует раннему (до старта фармакотерапии или на стадии титрации доз) прогнозированию межиндивидуальной вариативности фармакологического ответа на АП (эффективности и безопасности) и позволяет персонализированно подойти к подбору психофармакотерапии. Это позволит повысить качество и эффективность медицинской помощи пациентам с психическими расстройствами [67–69]. В связи с этим внедрение ФГТ-панелей в реальную клиническую практику для оценки скорости Р-окисления АП в печени весьма актуально.
В настоящее время использование ФГТ активно внедряется в клиническую психиатрическую практику в России и за рубежом [70]. Ряд инструкций к ЛС, клинических руководств и рекомендаций уже включают ФГТ в качестве метода персонализации фармакотерапии, что основано на накопленной доказательной базе эффективности подобного рода подходов.
Пациенты с психическими расстройствами особенно нуждаются в проведении ФГТ, поскольку многие используемые в клинической практике АП вызывают различные уровни лекарственного ответа и широкий спектр НР. Более широкое использование фармакогенетических исследований в психиатрии и наркологии особенно необходимо ввиду того, что зачастую лекарственную терапию пациентам с психическими расстройствами применяют длительно, большинство ЛС обладают узкой терапевтической широтой, большим спектром и выраженностью НР, психотропные ЛС, включая АП, могут вызвать серьёзные острые и отсроченные НР и усугублять исходы течения заболевания [70].
Полученные при проведении ФГТ данные могут позволить практикующему врачу (психиатру и наркологу) достичь оптимального баланса между эффективностью и безопасностью антипсихотической терапии путём внедрения персонализированной стратегии оценки генетического риска развития АП-индуцированных НР, в частности ассоциированных с нарушением окисления АП в печени с участием изоферментов цитохрома Р450 у конкретного пациента [69]. При этом наибольшее внимание необходимо уделять пациентам с высоким риском развития АП-индуцированных НР, в частности гомозиготным носителям низкофункциональных и нефункциональных ОНВ / полиморфизмов изоферментов цитохрома Р450 печени.
Удачным примером системы для оценки генетического вклада в фармакокинетику и фармакодинамику ЛС, применяющейся в зарубежной психиатрической практике, является алгоритм GeneSight Psychotropic, разработанный группой учёных на базе клиники Мейсон (США). Тест неинвазивен и прост в применении: для сбора образца дезоксирибонуклеиновой кислоты (ДНК) пациента требуется только соскоб буккального эпителия. Результаты предоставляются врачу-психиатру или пациенту в течение 36 часов. В основе панели GeneSight лежит мультигенный многовариантный генетический тест, который учитывает особенности генотипа и фенотипа конкретного пациента, а также информацию о метаболизме ЛС. Анализ производится по 59 аллельным вариантам 6 генов, кодирующих изоферменты семейства CYP: CYP1A2, CYP2C9, CYP2C19, CYP3A4, CYP2B6, CYP2D6. Лечащему врачу предоставляется уже проанализированная программой информация по результатам ФГТ пациента с психическим расстройством. Заключение GeneSight содержит список АП и АД, разделённый на 3 категории: «использовать по назначению»; «использовать с осторожностью»; «использовать с повышенной осторожностью и с более частым мониторингом». Кроме того, заключение содержит дополнительную информацию, которая помогает психиатру принимать решение о назначении или отмене ЛС у конкретного пациента. Таким образом, данный алгоритм ФГТ позволяет психиатру принимать решение о назначении психофармакотерапии без привлечения клинического фармаколога в большинстве случаев [71][72].
Ещё один фармакогенетический тест GeneceptAssay, разработанный в США, позволяет клиническому фармакологу легко принимать решение о назначении АП и АД. Анализ результатов GeneceptAssay охватывает широкий спектр ЛС, используемых для психофармакотерапии различных психических расстройств. Исследование проводится по аллельным вариантам в 20 генах, включая 7 генов семейства CYP: CYP1A2, CYP2B6, CYP2C19, CYP2C9, CYP2D6, CYP3A4, CYP3A5. Заключение предоставляется в течение 8 рабочих дней в виде подробной таблицы с рекомендациями для лечащего врача по назначению ЛС для конкретного пациента, что способствует повышению эффективности и безопасности использования психотропных ЛС, включая АП [73][74].
Повышение уровня знаний практикующих врачей о путях и скорости окисления АП с печёночным и преимущественно печёночным путём метаболизма поможет рационально применять ФГТ в реальной клинической психиатрической практике. Это будет способствовать повышению эффективности и безопасности АП и повышению комплаентности пациентов к хронической психофармакотерапии, повышению качества их жизни, а также позволит снизить экономическое бремя государства по лечению распространённых и социально значимых психических расстройств и купированию НР, индуцированных приёмом АП [75–77].
Ограничение / Limitation
Ограничение этого тематического обзора состоит в том, что анализировались только публикации, посвящённые изучению пути окисления (фаза I) в метаболизме АП. Несомненно, для прогнозирования и управления АП-индуцированными НР необходимо учитывать роль и других путей метаболизма (например, глюкуронизации, метилирования и др.). Кроме того, окисление АП осуществляется не только в гепатоцитах, но также и в нейронах головного мозга, в частности с участием изоферментов CYP1A1 и CYP1B1, которые экспрессируются в ЭПР в различных органах и тканях [78][79]. Например, CYP1A1 экспрессируется в мозжечке, коре головного мозга, гиппокампе, щитовидной железе, паращитовидной железе, надпочечниках, бронхах, лёгких, слизистой рта, желудка, двенадцатиперстной кишке и т. д. [80]. Это, вероятно, может вызвать развитие специфических НР со стороны определённых органов и систем. Учёт вклада в развитие АП-индуцированных НР этих путей метаболизма также может помочь практикующему психиатру предположить, каким органам и системам при назначении АП необходимо уделять особое внимание, особенно при хронической психофармакотерапии. Однако этот подход только начал своё развитие, что требует дальнейшего исследования в будущем.
Заключение / Conclusion
Знание путей окисления АП в печени очень важно с теоретической и практической точек зрения, так как это может помочь достичь оптимального баланса между эффективностью и безопасностью АП. Кроме того, важно помнить, что трансляция результатов фундаментальных знаний об окислении ЛС в печени, как одном из ключевых путей метаболизма АП, в реальную практику возможна за счёт расширения знаний в области психофармакогенетики, разработки и внедрения в клиническую практику ФГТ, которое было бы полезно использовать не на стадии развития НР, но до начала назначения АП, что важно с позиции персонализированной, профилактической и предиктивной медицины.
Список литературы
1. Finkel R, Clark MA, Cubeddu LX. Pharmacology. 4th ed. Philadelphia: Lippincott Williams & Wilkins, 2008. P. 151.
2. Lally J, MacCabe JH. Antipsychotic medication in schizophrenia: a review. Br Med Bull. 2015 Jun;114(1):169–179. DOI: 10.1093/bmb/ldv017
3. Grande I, Berk M, Birmaher B, Vieta E. Bipolar disorder. Lancet. 2016;387(10027):1561–1572. DOI: 10.1016/S0140-6736(15)00241-X
4. Caroff SN, Hurford I, Lybrand J, Campbell EC. Movement disorders induced by antipsychotic drugs: implications of the CATIE schizophrenia trial. Neurol Clin. 2011 Feb;29(1):127–148, viii. DOI: 10.1016/j.ncl.2010.10.002
5. Sadock BJ, Sadock VA, Ruiz P. Kaplan and Sadock’s Comprehensive Textbook of Psychiatry. 9th ed. Philadelphia, PA, USA: Lippincott Williams & Wilkins, 2009. Pp. 4113–4119.
6. Meltzer HY. Update on typical and atypical antipsychotic drugs. Annu Rev Med. 2013;64:393–406. DOI: 10.1146/annurev-med-050911-161504
7. Sheehan JJ, Sliwa JK, Amatniek JC, Grinspan A, Canuso CM. Atypical antipsychotic metabolism and excretion. Curr Drug Metab. 2010 Jul;11(6):516– 525. DOI: 10.2174/138920010791636202
8. Rourke JL, Sinal CJ. Biotransformation/Metabolism. Encycl. Toxicol. 2014;1:490–502.
9. Shanu-Wilson J, Evans L, Wrigley S, Steele J, Atherton J, Boer J. Biotransformation: Impact and Application of Metabolism in Drug Discovery ACS Med Chem Lett. 2020 Aug 28;11(11):2087–2107. DOI: 10.1021/acsmedchemlett.0c00202
10. Shen WW. The metabolism of atypical antipsychotic drugs: an update. Ann Clin Psychiatry. 1999;11(3):145–158. DOI: 10.1023/a:1022312111429
11. Correia MA. Drug biotransformation. In Basic & Clinical Pharmacology, 14th ed.; Katzung BG, Ed. New York, NY, USA: McGraw Hill Education, 2017. Volume 1, pp. 56–74.
12. Josephy DP, Guengerich PF, Miners JO. “Phase I and Phase II” drug metabolism: terminology that we should phase out? Drug Metab Rev. 2005;37(4):575–580. DOI: 10.1080/03602530500251220
13. De Bruyn Kops C, Šícho M, Mazzolari A, Kirchmair J. GLORYx: Prediction of the Metabolites Resulting from Phase 1 and Phase 2 Biotransformations of Xenobiotics. Chem Res Toxicol. 2021;34(2):286–299. DOI: 10.1021/acs.chemrestox.0c00224
14. Guengerich FP. Common and uncommon cytochrome P450 reactions related to metabolism and chemical toxicity. Chem Res Toxicol. 2001;14(6):611–650. DOI: 10.1021/tx0002583
15. Bachmann K. Drug Metabolism. Pharmacology. 2009;8:131–173.
16. Beedham C. The role of non-P450 enzymes in drug oxidation. Pharm World Sci. 1997;19(6):255–263. DOI: 10.1023/a:1008668913093
17. Manikandan P, Nagini S. Cytochrome P450 Structure, Function and Clinical Significance: A Review. Curr Drug Targets. 2018;19(1):38–54. DOI: 10.2174/1389450118666170125144557
18. Danielson PB. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans. Curr Drug Metab. 2002;3(6):561– 597. DOI: 10.2174/1389200023337054
19. Pandey AV, Flück CE. NADPH P450 oxidoreductase: structure, function, and pathology of diseases. Pharmacol Ther. 2013 May;138(2):229– 254. DOI: 10.1016/j.pharmthera.2013.01.010
20. Jensen K, Møller BL. Plant NADPH-cytochrome P450 oxidoreductases. Phytochemistry. 2010;71(2–3):132–141. DOI: 10.1016/j.phytochem.2009.10.017
21. Klein MT, Torry LA, Wu BC, Townsend SH, Paspek SC. Hydrolysis in supercritical water: Solvent effects as a probe of the reaction mechanism. J Supercrit Fluids. 1990;3:222–227. DOI: org/10.1016/0896-8446(90)90026-I
22. Nelson DR. Cytochrome P450 diversity in the tree of life. Biochim Biophys Acta Proteins Proteom. 2018 Jan;1866(1):141–154. DOI: 10.1016/j.bbapap.2017.05.003
23. Клиническая психофармакогенетика / под ред. Насыровой Р. Ф., Незнанова Н. Г. СПб.: Издательство ДЕАН, 2019. С. 97–174. [Klinicheskaya psikhofarmakogenetika. Ed by. Nasyrova RF, Neznanova NG. SPb.: Izdatel’stvo DEAN, 2019. (In Russ).].
24. Uno Y, Iwasaki K, Yamazaki H, Nelson DR. Macaque cytochromes P450: nomenclature, transcript, gene, genomic structure, and function. Drug Metab Rev. 2011;43(3):346–361. DOI: 10.3109/03602532.2010.549492
25. Thomas LP, Laszlo K. Rapid Review Pharmacology. 3rd ed. The Netherlands (Amsterdam): Elsevier, 2010. Pp. 7–9.
26. Shnayder NA, Abdyrakhmanova AK, Nasyrova RF. Phase I of antipsychotics metabolism and its pharmacogenetic testing. Personalized Psychiatry and Neurology. 2022;2(1):4–21. DOI: 10.52667/2712-9179-2022-2-1-4-21
27. Nelson DR. The cytochrome p450 homepage. Hum Genomics. 2009;4(1):59–65. DOI: 10.1186/1479-7364-4-1-59
28. Guengerich FP. Mechanisms of cytochrome P450-catalyzed oxidations. ACS Catal. 2018;8(12):10964–10976. DOI: 10.1021/acscatal.8b03401
29. Rendic S, Di Carlo FJ. Human cytochrome P450 enzymes: a status report summarizing their reactions, substrates, inducers, and inhibitors. Drug Metab Rev. 1997;29(1–2):413–580. DOI: 10.3109/03602539709037591
30. Shnayder NA, Abdyrakhmanova AK, Nasyrova RF. Oxidation of antipsychotics. Encyclopedia. 2022;2:974–989. DOI: 10.3390/encyclopedia2020064
31. Le T, Bhushan V, Sochat M, Vaidyanathan V, Schimansky S, Abrams J, Kallianos K. First Aid for the USMLE Step 1. 30th ed. NY: McGraw Hill Education, 2020. Pp. 230, 252.
32. Machalz D, Pach S, Bermudez M, Bureik M, Wolber G. Structural insights into understudied human cytochrome P450 enzymes. Drug Discov Today. 2021;26(10):2456–2464. DOI: 10.1016/j.drudis.2021.06.006
33. Go.drugbank.com [Internet]: открытая база данных. Drug bank [cited 2022 Oct 19]. URL: https://go.drugbank.com/
34. Hukkanen J. Induction of cytochrome P450 enzymes: a view on human in vivo findings. Expert Rev Clin Pharmacol. 2012;5(5):569–585. DOI: 10.1586/ecp.12.39
35. Department of Medicine Clinical Pharmacology [Internet]. Drug Interactions Flockhart Table [cited 2022 Oct 19]. URL: https://druginteractions.medicine.iu.edu/MainTable.aspx.
36. Johansson I, Ingelman-Sundberg M. Genetic polymorphism and toxicology—with emphasis on cytochrome р450. Toxicol Sci. 2011;120(1):1–13. DOI: 10.1093/toxsci/kfq374
37. Medsafe: New Zealand Medicines and Medical Devices Safety Authority [Internet]. Drug Metabolism — The Importance of Cytochrome P450 3A4 [cited 2022 Oct 19]. URL: https://www.medsafe.govt.nz/profs/puarticles/march2014drugmetabolismcytochromep4503a4.htm.
38. Werk AN, Cascorbi I. Functional gene variants of CYP3A4. Clin Pharmacol Ther. 2014;96(3):340–348. DOI: 10.1038/clpt.2014.129
39. Bondy B, Zill P. Psychopharmacogenetics — a challenge for pharmacotherapy in psychiatry. World J Biol Psychiatry. 2001;2(4):178–183. DOI: 10.3109/15622970109026806
40. Насырова Р. Ф., Иванов М. В., Незнанов Н. Г. Введение в психофармакогенетику: монография. СПб.: Издательский центр СПб. НИПНИ им. В. М. Бехтерева, 2015. 272 с. [Nasyrova RF, Ivanov MV, Neznanov NG. Vvedenie v psikhofarmakogenetiku: monografiya. SPb.: Izdatel’skii tsentr SPb. NIPNI im. V. M. Bekhtereva, 2015. (In Russ).].
41. Абдырахманова А. К., Шнайдер Н. А., Насырова Р. Ф. Клинический случай поздней фармакогенетической диагностики нежелательных реакций на фоне психофармакотерапии у пациентки с рекуррентным депрессивным расстройством. Фармакогенетика и фармакогеномика. 2021;(2):21–23. [Abdyrakhmanova AK, Shnaider NA, Nasyrova RF. Klinicheskii sluchai pozdnei farmakogeneticheskoi diagnostiki nezhelatel’nykh reaktsii na fone psikhofarmakoterapii u patsientki s rekurrentnym depressivnym rasstroistvom. Farmakogenetika i farmakogenomika = Pharmacogenetics and pharmacogenomics. 2021;(2):21–23. (In Russ).]. DOI: 10.37489/2588-0527-2021-2-21-23
42. Abdyrakhmanova AK, Nasyrova RF. Pharmacogenetic testing of cytochrome p450 metabolizing enzymes in 28-year-old man with treatmentresistant schizophrenia. Personalized Psychiatry and Neurology. 2022;2(1):81–88. DOI: 10.52667/2712-9179-2022-2-1-81-88
43. Laika B, Leucht S, Heres S, Steimer W. Intermediate metabolizer: increased side effects in psychoactive drug therapy. The key to costeffectiveness of pretreatment CYP2D6 screening? Pharmacogenomics J. 2009;9(6):395–403. DOI: 10.1038/tpj.2009.23
44. Zhuravlev NM, Shnayder NA, Vaiman EE, Abdyrakhmanova AK, Petrova MM, Bochanova EN, Romanova IV, Gavrilyuk OA, Lareva NV, Nasyrova RF. Interindividual Variability of Anticonvulsant-Induced QT Prolongation Risk. Personalized Psychiatry and Neurology. 2022;2(1):22–45. DOI: 10.52667/2712-9179-2022-2-1-23-45
45. Lynch T, Price A. The effect of cytochrome P450 metabolism on drug response, interactions, and adverse effects. Am Fam Physician. 2007;76(3):391–396.
46. Кукес В. Г., Иванец Н. Н., Сычёв Д. А., Псарева Н. А. Фармакогенетика системы цитохрома Р-450 и безопасность терапии антидепрессантами. Биомедицина. 2014;1(1):67–80. [Kukes VG, Ivanets NN, Sychev DA, Psareva NA. Cytochrome P-450 pharmacogenetics and antidepressants treatment safety. Journal Biomed. 2014;1(1):67–80. (In Russ).]. URL: https://journal.scbmt.ru/jour/article/view/305/210. Ссылка активна на 01.12.2022.
47. Dobrodeeva VS, Abdyrahmanova AK, Nasyrova RF. Personalized approach to antipsychotic-induced weight gain prognosis. Personalized Psychiatry and Neurology. 2021;1(1):3–10. DOI: 10.52667/2712-9179-2021-1-1-3-10
48. Nebert DW, Wikvall K, Miller WL. Human cytochromes P450 in health and disease. Philos Trans R Soc Lond B Biol Sci. 2013;368(1612): 20120431. DOI: 10.1098/rstb.2012.0431
49. GeneCards [Internet]: открытая база данных. The Human Gene Database [cited 2022 Oct 19]. URL: https://www.genecards.org/.
50. Proteinatlas.org [Internet]. The Humаn Protein Atlas [cited 2022 Oct 19]. URL: https://www.proteinatlas.org/.
51. Kawajiri K. CYP1A1. IARC Sci Publ. 1999;(148):159–172.
52. Guo J, Zhu X, Badawy S, et al. Metabolism and Mechanism of Human Cytochrome P450 Enzyme 1A2. Curr Drug Metab. 2021;22(1):40–49. DOI: 10.2174/1389200221999210101233135
53. Hong CC, Tang BK, Rao V, et al. Cytochrome P450 1A2 (CYP1A2) activity, mammographic density, and oxidative stress: a cross-sectional study. Breast Cancer Res. 2004;6(4):R338–51. DOI: 10.1186/bcr797
54. Raunio H, Rahnasto-Rilla M. CYP2A6: genetics, structure, regulation, and function. Drug Metabol Drug Interact. 2012;27(2):73–88. DOI: 10.1515/dmdi-2012-0001
55. Backman JT, Filppula AM, Niemi M, Neuvonen PJ. Role of сytochrome P450 2C8 in drug metabolism and interactions. Pharmacol Rev. 2016;68(1):168–241. DOI: 10.1124/pr.115.011411
56. Waring RH. Cytochrome P450: genotype to phenotype. Xenobiotica. 2020;50(1):9–18. DOI: 10.1080/00498254.2019.1648911
57. Amorosi CJ, Chiasson MA, McDonald MG, et al. Massively parallel characterization of CYP2C9 variant enzyme activity and abundance. Am J Hum Genet. 2021;108(9):1735–1751. DOI: 10.1016/j.ajhg.2021.07.001
58. Zhu-Ge J, Yu YN. Enzyme activity analysis of CYP2C18 with exon 5 skipped. Acta Pharmacol Sin. 2004;25(8):1065–1059.
59. Wedlund PJ. The CYP2C19 enzyme polymorphism. Pharmacology. 2000;61(3):174–183. DOI: 10.1159/000028398
60. Ingelman-Sundberg M. Genetic polymorphisms of cytochrome P450 2D6 (CYP2D6): clinical consequences, evolutionary aspects and functional diversity. Pharmacogenomics J. 2005;5(1):6–13. DOI: 10.1038/sj.tpj.6500285
61. Guengerich FP. Cytochrome P450 2E1 and its roles in disease. Chem Biol Interact. 2020;322:109056. DOI: 10.1016/j.cbi.2020.109056
62. Werk AN, Cascorbi I. Functional gene variants of CYP3A4. Clin Pharmacol Ther. 2014;96(3):340–348. DOI: 10.1038/clpt.2014.129
63. Smith SA, Colley HE, Sharma P, et al. Expression and enzyme activity of cytochrome P450 enzymes CYP3A4 and CYP3A5 in human skin and tissue-engineered skin equivalents. Exp Dermatol. 2018;27(5):473–475. DOI: 10.1111/exd.13483
64. Li H, Lampe JN. Neonatal cytochrome P450 CYP3A7: A comprehensive review of its role in development, disease, and xenobiotic metabolism. Arch Biochem Biophys. 2019;673:108078. DOI: 10.1016/ j.abb.2019.108078
65. Brandl EJ, Chowdhury NI, Tiwari AK, et al. Genetic variation in CYP3A43 is associated with response to antipsychotic medication. J Neural Transm (Vienna). 2015;122(1):29–34. DOI: 10.1007/s00702-014-1298-8
66. Javaid JI. Clinical pharmacokinetics of antipsychotics. J Clin Pharmacol. 1994;34(4):286–295. DOI: 10.1002/j.1552-4604.1994.tb01995.x
67. Иващенко Д. В., Насырова Р. Ф., Иванов М. В., Незнанов Н. Г. История фармакогенетики в психиатрии. Фармакогенетика и фармакогеномика. 2015;(2):33–40. [Ivashchenko DV, Nasyrova RF, Ivanov MV, Neznanov NG. The history of pharmacogenetics in psychiatry. Pharmacogenetics and Pharmacogenomics. 2015;(2):33–40. (In Russ).]. URL: https://www.pharmacogenetics-pharmacogenomics.ru/jour/article/view/178?locale=ru_RU. Ссылка активна на 01.12.2022.
68. Иващенко Д. В., Сосин Д. Н., Кирничная К. А., Ершов Е. Е., Тараскина А. Е., Иванов М. В., Сычёв Д. А., Насырова Р. Ф., Незнанов Н. Г. Экономическая целесообразность фармакогенетического тестирования при назначении антипсихотиков. Фармакогенетика и фармакогеномика. 2015;(1):30–39. [Ivashchenko DV, Sosin DN, Kirnichnaya KA, Ershov EE, Taraskina AE, Ivanov MV, Sychev DA, Nasyrova RF, Neznanov NG. The economic feasibility of pharmacogenetic-based prescribing of antipsychotics: a review. Pharmacogenetics and Pharmacogenomics. 2015;(1):30–39. (In Russ).].
69. Насырова Р. Ф., Добродеева В. С., Скопин С. Д., Шнайдер Н. А., Незнанов Н. Г. Проблемы и перспективы внедрения фармакогенетического тестирования в реальной клинической практике в Российской Федерации. Вестник психиатрии, неврологии и нейрохирургии. 2020;(3):2–7. [Nasyrova RF, Dobrodeeva VS, Skopin SD, Shnaider NA, Neznanov NG. Problems and prospects for the implementation of pharmacogenetic testing in real clinical practice in the Russian Federation. Bulletin of Neurology, Psychiatry and Neurosurgery. 2020;(3):2–7. (In Russ).]. DOI: 10.33920/med-01-2003-01
70. Сычёв Д. А., Кукес В. Г., Ташенова А. И. Фармакогенетическое тестирование — новая медицинская технология. Медицинские технологии. Оценка и выбор. 2010;(2):39–43. [Sychev DA, Kukes VG, Tashenova AI. Pharmacogenetic Testing: a New Medical Technology. Meditsinskie tekhnologii. Otsenka i vybor. 2010;(2):39–43. (In Russ).].
71. Bond T. Third clinical trial reinforces the use of the GeneSight® pharmacogenomic test. Pharmacogenomics. 2014;15(3):257. DOI: 10.2217/pgs.14.7
72. Genesight.com [Internet]. GeneSight test [cited 2022 Oct 19]. Available from: https://genesight.com/.
73. Howland RH. Pharmacogenetic testing in psychiatry: not (quite) ready for primetime. J Psychosoc Nurs Ment Health Serv. 2014;52(11):13–16. DOI: 10.3928/02793695-20141021-09
74. Dynacare [Internet]. Genecept Assay [cited 2022 Oct 19]. Available from: https://www.dynacare.ca/patients-and-individuals/health-solutions/mental-health-solutions.aspx.
75. Lara DV, Melo DO, Silva RAM, Santos PCJL. Pharmacogenetic testing in psychiatry and neurology: an overview of reviews. Pharmacogenomics. 2021;22(8):505–513. DOI: 10.2217/pgs-2020-0187
76. Kumar A, Kearney A. The use of pharmacogenetic testing in psychiatry. J Am Assoc Nurse Pract. 2021;33(11):849–851. Published 2021 Nov 10. DOI: 10.1097/JXX.0000000000000666
77. Gardner KR, Brennan FX, Scott R, Lombard J. The potential utility of pharmacogenetic testing in psychiatry. Psychiatry J. 2014;2014:730956. doi: 10.1155/2014/730956
78. Genecards.org [Internet]. CYP1A1 Gene — Cytochrome P450 Family 1 Subfamily A Member 1 [cited 2022 Oct 19]. Available from: https://www.genecards.org/cgi-bin/carddisp.pl?gene=CYP1A1.
79. Genecards.org [Internet]. CYP1B1 Gene — Cytochrome P450 Family 1 Subfamily B Member 1 [cited 2022 Oct 19]. Available from: https://www.genecards.org/cgi-bin/carddisp.pl?gene=CYP1B1.
80. Proteinatlas.org [Internet]. The Human Protein Atlas: CYP1A1 [cited 2022 Oct 19]. Available from: https://www.proteinatlas.org/ENSG00000140465-CYP1A1/tissue.
Об авторах
Н. А. ШнайдерРоссия
д. м. н., профессор, в. н. с., заместитель руководителя Института персонализированной психиатрии и неврологии
Санкт-Петербург
в. н. с.
Красноярск
А. К. Хасанова
Россия
лаборант кафедры психиатрии
Москва
Р. Ф. Насырова
Россия
д. м. н., гл. н. с., руководитель Института персонализированной психиатрии и неврологии
Санкт-Петербург
Рецензия
Для цитирования:
Шнайдер Н.А., Хасанова А.К., Насырова Р.Ф. Первая фаза метаболизма антипсихотиков в печени: роль окисления. Фармакогенетика и фармакогеномика. 2022;(1):15-30. https://doi.org/10.37489/2588-0527-2022-1-15-30
For citation:
Shnayder N.A., Khasanova A.K., Nasyrova R.F. First phase of antipsychotic metabolism in the liver: the role of oxidation. Pharmacogenetics and Pharmacogenomics. 2022;(1):15-30. (In Russ.) https://doi.org/10.37489/2588-0527-2022-1-15-30











































