Перейти к:
Оценка безопасности нового противотуберкулёзного препарата in silico и при участии здоровых добровольцев
https://doi.org/10.37489/2588-0527-2021-1-42-47
Аннотация
Актуальность. В связи с ростом числа случаев туберкулёза с множественной лекарственной устойчивостью (МЛУ-ТБ) актуален поиск новых противотуберкулёзных препаратов (ПТП). Одно из главных направлений разработки ПТП – это оценка его влияния на организм человека вне аспекта терапевтического эффекта.
Цель. Оценка возможной токсичности тиозонида, нового отечественного ПТП, сочетающая последовательное изучение этой стороны применения препарата при помощи биоинформатического подхода и анализ результатов клинического исследования безопасности.
Методы. Биоинформатическая оценка проводилась при помощи веб-сервисов и моделей, позволяющих предсказать токсичность тиозонида. Оценка безопасности в отношении здоровых добровольцев производилась в рамках клинического исследования по протоколу: «Открытое исследование I фазы по изучению фармакокинетики, безопасности и переносимости препарата тиозонид, капсулы 100 мг при однократном приёме возрастающих доз различными группами здоровых добровольцев» (2013, Разрешение № 187 на проведение клинического исследования от 22 марта 2013 года, выданное Министерством здравоохранения Российской федерации).
Результаты. Были выделены потенциальные нежелательные мишени, величина предсказанного значения активности в отношении которых больше 7. Полученные результаты говорят о вероятности влияния тиозонида на эти белковые мишени и, возможно, способности последнего вызывать побочные эффекты, сопряжённые с изменением активности этих молекул. Не прогнозируется цитотоксического и канцерогенного эффекта тиозонида. В ходе клинического исследования препарат тиозонид показал хорошую переносимость и безопасность, поскольку выявленные нежелательные явления не показали определённой или достоверной связи с исследуемым препаратом. Разрешение всех нежелательных явлений было полным, а эскалация дозы не повлияла на количество, степень тяжести НЯ и связь с исследуемым препаратом.
Заключение. Анализ безопасности тиозонида продемонстрировал его хорошую переносимость как в ходе оценки методами in silico, так и в исследовании с участием здоровых добровольцев.
Для цитирования:
Савченко А.Ю., Раменская Г.В., Кукес В.Г., Буренков М.С., Шилов Б.В. Оценка безопасности нового противотуберкулёзного препарата in silico и при участии здоровых добровольцев. Фармакогенетика и фармакогеномика. 2021;(1):42-47. https://doi.org/10.37489/2588-0527-2021-1-42-47
For citation:
Savchenko A.Yu., Ramenskaya G.V., Kukes V.G., Burenkov M.S., Shilov B.V. Safety assessment of a new anti-tuberculosis drug in silico and with the participation of healthy volunteers. Pharmacogenetics and Pharmacogenomics. 2021;(1):42-47. (In Russ.) https://doi.org/10.37489/2588-0527-2021-1-42-47
Введение / Introduction
Туберкулёз (ТБ) представляет собой огромное социально-экономическое бремя и остаётся в десятке основных причин смерти во всем мире, несмотря на огромные усилия учреждений здравоохранения и исследователей. Основное беспокойство в связи с относительно более медленными темпами обуздания туберкулёза вызывает появление множественной лекарственной устойчивости (МЛУ) возбудителя [1]. Одной из тенденций борьбы с МЛУ является перепрофилирование и возрождение уже известных лекарств наряду с разработкой новых ПТП [2]. В России в последнее десятилетие зарегистрированы два зарубежных препарата: бедаквилин и деламанид, а также один отечественный — перхлозон [3–5]. Значимой представляется новая отечественная разработка — препарат из группы диарилхинолинов с рабочим названием тиозонид, по химической структуре представляющий собой —{1R,2S+1S,2R}-1-(6-Бром-2-хлорхинолил-3- ил)-4-(диметиламино)-2-(нафталин-1-ил)-1-фенилбутан-2-ол (порошок белого или белого с желтоватым оттенком цвета, нерастворим в воде, нерастворим в изотоническом растворе, 1 г/л растворим в метаноле, 10 г/л – в хлороформе (раствор облучают на ультразвуковой бане в течение 10 минут) [6].
Одно из основополагающих направлений разработки ПТП — это оценка его влияния на организм человека вне аспекта терапевтического эффекта. Целью настоящего исследования явилась оценка возможной токсичности тиозонида, сочетающая последовательное изучение при помощи биоинформатического подхода и анализ результатов клинического исследования безопасности нового препарата.
Материалы и методы / Materials and methods
Биоинформатическая оценка безопасности / Bioinformatic safety assessment. Предсказание острой токсичности у крыс проводилось с использованием веб-сервиса «ACUTE RAT TOXICITY PREDICTION» [http://www.way2drug.com/gusar/acutoxpredict.html]. В веб-сервисе предсказание значений LD50 для крыс при использовании четырёх различных методов введения препарата (per os, внутривенно, внутрибрюшинно и подкожно) проводилось с применением QSAR моделей, построенных с использованием программы GUSAR [7]. Обучающие выборки включали информацию о приблизительно 10000 химических структурах и соответствующие данные об острой токсичности в экспериментах на крысах. Результаты о моделировании подкожного введения препарата оказались вне домена применимости модели, и поэтому они не вошли в итоговую оценку. Модели QSAR для набора из 32 моделей величин (IC50, Ki, Kact) описывали взаимодействие четырёх тысяч химических соединений с 18 нежелательными белками-мишенями (13 рецепторов, 2 фермента и 3 переносчика) [8]. Сервис «CLC-Pred: in silico prediction of cytotoxicity for tumor and non-tumor cell lines» [http://way2drug.com/Cell-line/index.php], предназначенный для предсказания острой цитотоксичности, является результатом обработки экспериментальных данных на обучающей выборке из 59 882 структур соединений, который отражает современные знания о цитотоксических веществах в отношении 943 раковых и нераковых линий клеток человека. Этим сервисом воспользовались для оценки возможной цитотоксичности тиозонида [9][10].
Оценка безопасности в отношении человека / Human safety assessment. Проведена оценка безопасности в отношении человека в рамках исследования по протоколу: «Открытое исследование I фазы по изучению фармакокинетики, безопасности и переносимости препарата тиозонид, капсулы 100 мг при однократном приёме возрастающих доз различными группами здоровых добровольцев» (20132013, Разрешение № 187 на проведение клинического исследования от 22 марта 2013 года, выданное Министерством здравоохранения Российской Федерации). В исследовании приняли участие 40 добровольцев мужского пола. Диагноз и основные критерии включения: Верифицированный диагноз «Здоров». Основные критерии включения:
- Письменно оформленное Информированное согласие на участие в исследовании.
- Пол — мужской.
- Возраст — 18–45 лет включительно.
- Масса тела — от 60 до 100 кг включительно, ИМТ – от 18 до 32 кг/м2.
- Отрицательный результат обследования на серологические маркеры ВИЧ, вирусных гепатитов В и С, сифилиса.
- Верифицированный диагноз «здоров»: отсутствие патологии со стороны желудочно-кишечного тракта, печени, почек, сердечно-сосудистой системы, ЦНС (предварительно проведенные стандартные клинико-лабораторные и инструментальные исследования не выявили наличия каких-либо заболеваний).
- Согласие на использование адекватных методов барьерной контрацепции добровольцем в период исследования и в течение 3 месяцев после него.
- Пациенты были подразделены на 4 группы, в зависимости от дозировки однократного приёма препарата тиозонид (25, 100, 400 и 600 мг). Исследование лекарственного препарата для каждого добровольца состояло из периода скрининга, госпитализации и периода «наблюдения» на протяжении 28 дней с момента приёма препарата. Состояние оценивалось врачом по основным жизненно-важным показателям, а также по динамике изменений состава периферической крови, биохимических показателей крови и мочи, электрокардиограммы, гемодинамических показателей (САД, ДАД, ЧСС) и температуры тела.
Оценка безопасности и переносимости производилась по следующим критериям.
1. Наличие/отсутствие дозолимитирующей токсичности.
2. Частота и степень выраженности случаев развития НЯ и СНЯ в группах наблюдения с последовательной эскалацией дозы, связанных, по мнению исследователей, с введением исследуемого препарата.
3. Количество случаев досрочного прекращения участия в исследовании из-за развития НЯ и СНЯ.
4. Оценка изменений данных клинических показателей и лабораторных обследований.
Полученные данные подвергались статистической обработке согласно задаче исследования. В биоинформатической части использовались возможности соответствующих инструментов сервисов; при доклинической и клинической оценке безопасности – при помощи программы STATISTICA 6.0 for Windows с использованием критерия хи-квадрат. Если достигнутый уровень значимости различий не превышал 0,05, их считали достоверными [11].
Результаты / Results
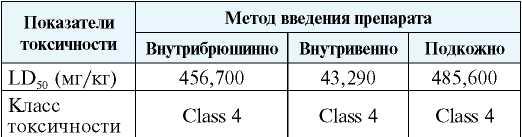
В табл. 1 представлены результаты прогноза препарата тиозонид с указанием дозы вещества, прогнозирующей гибель 50 % крыс в эксперименте. В таблице также представлен класс токсичности препарата для различных методов. Во всех случаях предсказана низкая токсичность (Class 4) по классификации токсичности химических соединений проекта OECD [http://www.oecd.org/chemicalsafety/].
Таблица 1
Результаты предсказания дозы препарата тиозонид, приводящей к гибели 50 % (LD50) крыс в эксперименте
Table 1
Results of prediction of the dose of the thiosonide preparation leading to the death of 50 % (LD50) of rats in the experiment
Предсказание нежелательных мишеней препарата тиозонид, связанных с побочными эффектами, также проводилось с использованием веб сервиса на основе программы GUSAR [http://www.way2drug.com/gusar/antitargets.html]. Количественное значение предсказанной активности представлено в табл. 2.
Таблица 2
Значение предсказанной активности для препарата тиозонид в отношении нежелательных мишеней, связанных с возможными побочными эффектами
Table 2
The value of the predicted activity for the drug thiosonide against to targets associated with possible side effects
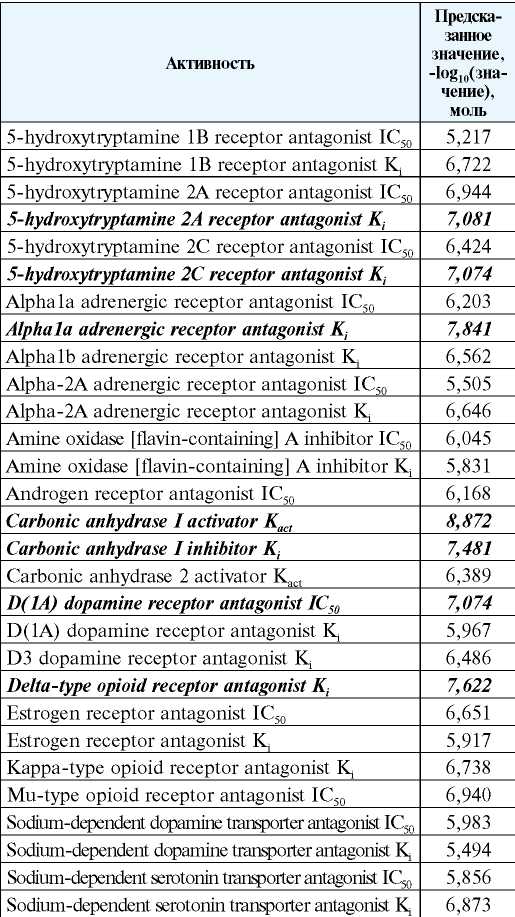
Нужно отметить выделенные потенциальные нежелательные мишени, величина предсказанного значения которых больше 7 (в табл. 2 выделено жирным курсивом). Наблюдаемая картина может свидетельствовать в пользу высокой вероятности влияния тиозонида на эти белковые мишени и, возможно, способности последнего вызывать побочные эффекты, сопряженные с изменением активности этих молекул.
Сервис «CLC-Pred: in silico prediction of cytotoxicity for tumor and non-tumor cell lines» [http://way2drug.com/Cell-line/index.php] не смог отнести тиозонид с достаточной надёжностью ни к одной из групп, вызывающих цитотоксический эффект. Следовательно, по данным этого способа оценки, вероятность цитотоксического действия изучаемой молекулы является незначительной. Аналогично сервис “ROSC-Pred: web-service for rodent organ-specific carcinogenicity
prediction” [http://www.way2drug.com/ROSC/], предназначенный для предсказания канцерогенности веществ, не дал значимых результатов, показав низкие значения вероятности отнесения молекулы тиозонида к группе канцерогенных соединений, протестированных на грызунах.
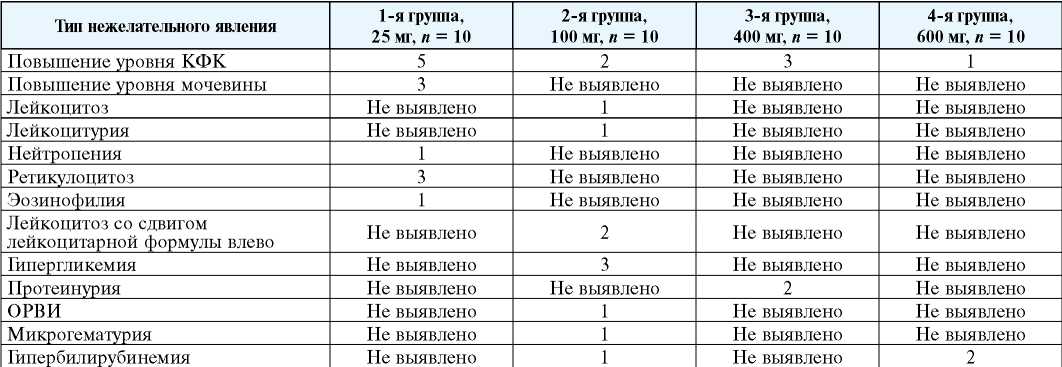
Клиническая оценка безопасности / Clinical safety assessment. В ходе клинического исследования безопасности у пациентов, принимавших препарат не было отмечено клинически значимых колебаний в состоянии кожных покровов, функционировании основных систем органов и показателей периферической крови, биохимических характеристик крови и мочи, а также основных жизненно важных параметров, таких как гемодинамические показатели, данные электрокардиографического обследования и температура тела. Кумулированный список всех нежелательных явлений (НЯ) со стороны различных систем представлен в табл. 3.
Таблица 3
Общее количество всех нежелательных явлений, не связанных с приёмом препарата тиозонид, выявленных в ходе клинической оценки его безопасности и переносимости
Table 3
Total number of all adverse events not associated with taking the drug thiosonide identified during of its safety and tolerability clinical assessment
В ходе проведённого клинического исследования препарат тиозонид показал хорошую переносимость и безопасность, поскольку выявленные нежелательные явления не показали определённой или достоверной связи с исследуемым препаратом. Разрешение всех зарегистрированных нежелательных явлений было полным, а эскалация дозы не повлияла на количество, степень тяжести НЯ и связь с исследуемым препаратом. По результатам врачебных осмотров, проведённых в ходе исследования, а также сравнительного анализа обобщённых данных врачебного осмотра до (скрининг) и по окончании исследования не было выявлено каких-либо отклонений в состоянии здоровья добровольцев, принимавших участие в исследовании. Мониторинг жизненно-важных показателей, проведённых в процессе исследования, а также сравнительного анализа обобщённых результатов этих показателей до (скрининг) и по окончании исследования показал, что достоверных изменений у добровольцев по жизненно-важным показателям не было. Результаты мониторинга ЭКГ в ходе исследования, а также сравнительного анализа обобщённых результатов ЭКГ до (скрининг) и по окончании исследования не выявили клинически значимых изменений, угрожающих жизни и здоровью добровольцев.
Обсуждение результатов / Discussion of the results
В период с 2014 года до 2016 года на 52,3 % в нашей стране увеличилось число пациентов с туберкулёзом с широкой лекарственной устойчивостью возбудителя (ШЛУ-ТБ). Он характеризуется высокой летальностью (от 28 до 43 %), более высокой стоимостью и длительностью лечения не только по сравнению с терапией лекарственно-чувствительного ТБ, но и МЛУ-ТБ, а также дополнительной устойчивостью к препаратам второго ряда — некоторым фторхинолонам [12][13]. Длительность терапии — один из факторов, которые лежат в основе возникновения устойчивости возбудителя. Помимо этого, происходит кумуляция побочных эффектов лекарственного вещества, формируются нежелательные побочные реакции со стороны важнейших систем жизнеобеспечения, часто лимитируя лечение заболевания [14][15]. Подчас возбудитель способен вырабатывать устойчивость в короткие сроки: уже сейчас в Азиатско-Тихоокеанском регионе описаны случаи клинической устойчивости возбудителя к бедаквилину, который считается одним из новейших ПТП. На основе данных биоинформатики создана модель прогнозирования устойчивости к этому препарату, которая бесплатно доступна через удобный веб-интерфейс под названием SUSPECT-BDQ, «Предписание структурной восприимчивости бедаквилина» (http://biosig.unimelb.edu.au/suspect_bdq/). Авторы полагают, что этот сервис поможет эффективно использовать бедаквилин и минимизировать распространение клинической резистентности к этому ПТП. [16]. Таким образом, по-прежнему одно из ключевых мест в разработке противотуберкулёзного препарата занимает оценка его безопасности. Неблагоприятные воздействия препаратов этой группы могут обладать жизнеугрожающим действием, каковым является нефротоксичность аминогликозидов, кардиотоксичность фторхинолонов, желудочно-кишечная токсичность этионамида или пара-аминосалициловой кислоты, токсичность циклосерина в отношении центральной нервной системы [17][18]. В этой связи полученный профиль безопасности тиозонида позволяет рассчитывать на его хорошую переносимость и пригодность к использованию для терапии туберкулёза с множественной лекарственной устойчивостью возбудителя.
Заключение / Conclusion
Проведённый комплексный анализ безопасности нового ПТП из группы диарилхинолинов с рабочим названием тиозонид убедительно продемонстрировал его хорошую переносимость как в ходе оценки методами in silico, так и в исследовании с участием здоровых добровольцев.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors state that there is no conflict of interest.
Список литературы
1. Arya A, Singh S, Dwivedi VD, Shakila H. Integration of biometric ID for the effective collection and epidemiological evaluation of antibiotic prescription in tuberculosis and other diseases: A medical hypothesis. J Glob Antimicrob Resist. 2020;21:439–444. DOI: 10.1016/j.jgar.2019.12.003.
2. Sharma D, Dhuriya YK, Deo N, Bisht D. Repurposing and Revival of the Drugs: A New Approach to Combat the Drug Resistant Tuberculosis. Front Microbiol. 2017;8:2452. DOI: 10.3389/fmicb.2017.02452.
3. Li Y, Sun F, Zhang W. Bedaquiline and delamanid in the treatment of multidrug-resistant tuberculosis: Promising but challenging. Drug Dev Res. 2019;80(1):98–105. DOI: 10.1002/ddr.21498.
4. Keam SJ. Pretomanid: first approval. Drugs. 2019;79(16):1797–1803. DOI: 10.1007/s40265-019-01207-9.
5. Яблонский П.К., Виноградова Т.И., Левашев Ю.Н. и др. Доклинические и клинические исследования нового противотуберкулёзного препарата «Перхлозон®». Клиническая микробиология и антимикробная химиотерапия. 2016;18(1):42–48.
6. Меньшикова Л.А. Фармакокинетическое исследование оригинального лекарственного средства тиозонида: Дис. ... канд. фармацевт. наук. – Москва; 2016.
7. Lagunin A, Zakharov A, Filimonov D, Poroikov V. QSAR modelling of rat cute toxicity on the basis of PASS prediction. Mol Inform. 2011;30(2-3):241–250. DOI: 10.1002/minf.201000151.
8. Zakharov AV, Lagunin AA, Filimonov DA, Poroikov VV. Quantitative prediction of antitarget interaction profiles for chemical compounds. Chem Res Toxicol. 2012;25(11):2378–2385. DOI: 10.1021/tx300247r.
9. Lagunin AA, Dubovskaja VI, Rudik AV et al. CLC-Pred: a freely available web-service for in silico prediction of human cell line cytotoxicity for drug-like compounds. PLOS One. 2018;13(1):e0191838. DOI: 10.1371/journal.pone.0191838.
10. Lagunin AA, Rudik A, Filimonov D et al. ROSC-Pred: web-service for rodent organ-specific carcinogenicity prediction. Bioinformatics. 2018;34(4):710–712. DOI: 10.1093/bioinformatics/btx678.
11. Боровиков В.П., Боровиков И.П. Статистический анализ и обработка данных в среде Windows. – М.: Филинъ; 1997.
12. Нечаева О.Б. Эпидемическая ситуация по туберкулёзу в России. Туберкулёз и болезни лёгких. 2018;96(8):15–24.
13. Стерликов С.А., Русакова Л.И., Сон И.М. Исходы случаев лечения туберкулёза с широкой лекарственной устойчивостью: результаты трёхлетнего наблюдения. Современные проблемы здравоохранения и медицинской статистики. 2018;(2):14–26.
14. Филинюк О.В., Фелькер И.Г., Янова Г.В., Буйнова Л.Н., Колоколова О.В. Факторы риска неэффективной химиотерапии больных туберкулёзом с множественной лекарственной устойчивостью. Туберкулёз и болезни лёгких. 2014;(1):20–26.
15. Щегерцов Д.Ю., Филинюк О.В., Буйнова Л.Н., Земляная Н.А., Кабанец Н.Н., Аллилуев А.С. Нежелательные побочные реакции при лечении больных туберкулёзом с множественной лекарственной устойчивостью возбудителя. Туберкулёз и болезни лёгких. 2018;96(3):35–43.
16. Karmakar M, Rodrigues CHM, Holt KE et al. Empirical ways to identify novel Bedaquiline resistance mutations in AtpE. PLOS One. 2019;14(5):e0217169. DOI: 10.1371/journal.pone.0217169.
17. Бенеманский В.В., Юшков Г.Г., Бун М.М. и др. Экспериментально-клиническая характеристика токсичности применяемых противотуберкулёзных препаратов (обзор). Бюллетень Восточно-Сибирского НЦ СО РАМН. 2011;79(3):133–139
18. Ramachandran G, Swaminathan S. Safety and tolerability profile of second-line anti-tuberculosis medications. Drug Saf. 2015;38(3):253–269. DOI: 10.1007/s40264-015-0267-y.
Об авторах
А. Ю. СавченкоРоссия
Савченко Алла Юрьевна, в. н. с. лаборатории фармакомоделирования
SPIN-код: 8181-4165
Московская область
Г. В. Раменская
Россия
Раменская Галина Владиславовна, д. фарм. н., профессор, директор Института фармации
SPIN-код: 3948-5067
Москва
В. Г. Кукес
Россия
Кукес Владимир Григорьевич, д. м. н., профессор, академик РАН, Филиал «Клиническая фармакология»
SPIN-код: 8498-3521
Москва
М. С. Буренков
Россия
Буренков Михаил Сергеевич, к. б. н., менеджер по доклиническим исследованиям
Москва
Б. В. Шилов
Россия
Шилов Борис Владимирович, к. м. н, доцент кафедры биоинформатики
SPIN-код: 7355-5191
Москва
Рецензия
Для цитирования:
Савченко А.Ю., Раменская Г.В., Кукес В.Г., Буренков М.С., Шилов Б.В. Оценка безопасности нового противотуберкулёзного препарата in silico и при участии здоровых добровольцев. Фармакогенетика и фармакогеномика. 2021;(1):42-47. https://doi.org/10.37489/2588-0527-2021-1-42-47
For citation:
Savchenko A.Yu., Ramenskaya G.V., Kukes V.G., Burenkov M.S., Shilov B.V. Safety assessment of a new anti-tuberculosis drug in silico and with the participation of healthy volunteers. Pharmacogenetics and Pharmacogenomics. 2021;(1):42-47. (In Russ.) https://doi.org/10.37489/2588-0527-2021-1-42-47










































