Перейти к:
Генетические и физиологические предпосылки к индивидуальному воздействию селективных ингибиторов обратного захвата серотонина во время беременности и грудного вскармливания
https://doi.org/10.37489/2588-0527-2022-1-6-14
Аннотация
Тревожные и депрессивные расстройства очень широко распространены во время беременности. В послеродовом периоде они могут усугубляться в результате гормональных изменений, происходящих с женщиной, и приводить к фатальным последствиям, перерастая в большую депрессию. Наиболее распространённой группой лекарственных средств для амбулаторного лечения расстройств тревожно-депрессивного спектра являются селективные ингибиторы обратного захвата серотонина. В связи с отсутствием клинических исследований, которые бы проводились с участием беременных и кормящих, об эффективности и безопасности этой группы можно судить только на основании данных, полученных в реальной жизни. Ввиду того, что, очевидно, все представители группы имеют приблизительно схожий профиль эффективности и безопасности, выбор одного из представителей может вызывать затруднения. В нашей статье мы провели анализ влияния генетических факторов, влияющих на фармакокинетику этих препаратов, с целью выявления наиболее значимых из них и указания на тех представителей, которые могут характеризоваться большей фармакокинетической стабильностью и, с точки зрения фармакокинетики, могут оказаться сравнительно более клинически надёжными и безопасными для женщины и плода или новорождённого. Среди факторов, которые мы описываем, важное значение имеют данные об ожидаемых изменениях концентраций препаратов по мере прогрессирования беременности, вероятность предсуществующих, генетически обусловленных, индивидуальных особенностей фармакокинетики, потенциал межлекарственных взаимодействий, а также известные сведения о проникновении лекарств в организм ребёнка при полном грудном вскармливании.
Ключевые слова
Для цитирования:
Загородникова К.А., Новикова С.Ю. Генетические и физиологические предпосылки к индивидуальному воздействию селективных ингибиторов обратного захвата серотонина во время беременности и грудного вскармливания. Фармакогенетика и фармакогеномика. 2022;(1):6-14. https://doi.org/10.37489/2588-0527-2022-1-6-14
For citation:
Zagorodnikova K.A., Novikova S.Yu. Genetic and physiological factors predisposing to individual selective serotonine reuptake inhibitors exposure during pregnancy and breast feeding. Pharmacogenetics and Pharmacogenomics. 2022;(1):6-14. (In Russ.) https://doi.org/10.37489/2588-0527-2022-1-6-14
Введение / Introduction
Несмотря на то что большая часть лекарств для лечения экстрагенитальных заболеваний не разрешены к применению во время беременности, бремя болезней у беременных остаётся существенным. Особенную проблему составляют заболевания нервной системы. Так, по данным большинства исследований, распространённость перинатальной тревоги и депрессии составляет 8,5 и 13 % соответственно [1]. Пандемия новой коронавирусной инфекции накладывает свой отпечаток на эту область здоровья. Согласно данным множества исследований, распространённость тревоги и депрессии в период пандемии COVID-19 увеличивается [2]. Уровень тревоги существенно нарастает и среди беременных. Так, турецкие авторы оценили распространённость тревоги и депрессии среди беременных в период пандемии в 64 и 56 % соответственно [3]. Закономерно возрастает и потребность в антидепрессантах, частота применения которых в США среди беременных составляет 6–8 %, при этом наиболее часто используемой группой антидепрессантов являются селективные ингибиторы обратного захвата серотонина (СИОЗС) [4]. Необходимость оказания адекватной помощи беременным, страдающим тревожно-депрессивными расстройствами, подчёркивается свидетельствами негативного влияния депрессии на развитие детей и на адекватность грудного вскармливания [5][6]. Кроме того, антенатальная депрессия является фактором риска тяжёлых послеродовых депрессивных расстройств, которые могут закончиться фатально [7]. Несмотря на высокую частоту применения, степень изученности безопасности и эффективности СИОЗС во время беременности нельзя считать удовлетворительной. С точки зрения фармакокинетических факторов на внутригрупповые различия может оказывать влияние разница в скорости метаболизма первой фазы, обусловленная, в частности, задействованностью разных семейств цитохромов Р450. При этом риск чрезмерно высоких концентраций препарата связан с повышением лекарственного воздействия на плод и риском побочных эффектов у матери и новорождённого, а низкие концентрации, с другой стороны, создают риск недостаточной эффективности терапии. Вероятность значимых изменений фармакокинетики антидепрессантов группы СИОЗС может определяться распространённостью генетически предопределённых различий в метаболизме, вероятностью изменений активности цитохромов под действием гормональной перестройки, ассоциированной с прогрессированием беременности, риском лекарственных взаимодействий.
Благодаря большому количеству проведённых исследований однозначного представления о наличии или отсутствии рисков возникновения структурных аномалий плода в связи с применением СИОЗС сегодня нет. Многие исследователи связывают любыериски с сопутствующими факторами, но, так или иначе, у женщин, применяющих СИОЗС во время беременности, обнаруживают увеличение риска аномалий развития сердечно-сосудистой системы плода. В метаанализе, включившем 5 337 223 беременности, при использовании любых антидепрессантов в первом триместре отношение шансов составило 1,28 (95 % CI [1,17–1,41]); 1,57 (95 % CI [1,25–1,97]) для пароксетина; 1,36 (95 % CI [1,08–1,72]) для флуоксетина; 1,29 (95 % CI [1,14–1,45]) для сертралина [8].
Принято считать, что классические тератогенные эффекты в основном зависят от времени и степени воздействия, и для многих лекарственных средств определена дозозависимость в реализации тератогенного потенциала [9]. Сегодня нет достоверных данных о дозозависимости нежелательных эффектов СИОЗС, однако общие принципы диктуют необходимость поддержания минимальной достаточной и эффективной концентрации вещества в организме женщины в целях оказания ей оптимальной помощи и снижения даже небольшого возможно имеющегося риска для плода. Кроме того, значительные концентрации СИОЗС в организме ребёнка при рождении могут быть ассоциированы с синдромом нарушения адаптации. В недавно опубликованном крупном исследовании, включившем в анализ около 227 тысяч беременностей, протекавших на фоне применения СИОЗС, была отчётливо продемонстрирована дозозависимая взаимосвязь между применением антидепрессантов и формированием респираторного дистресс-синдрома у новорождённых (скорректированное отношение рисков от 1,26 (95 % CI [1,2–1,5]) до 2,23 (95 % CI [1,83–2,77]) [10], существует также очень низкий, но патогенетически понятный риск формирования персистирующей лёгочной гипертензии у новорождённых [11]. Применение СИОЗС также ассоциируется с увеличением риска послеродовых кровотечений (отношение шансов 1,25 (95 % CI [1,1–1,5]) [12].
Сохранение терапии в послеродовом периоде также имеет принципиально важное значение. Послеродовый период часто осложняется депрессивными расстройствами, поэтому после родов особенно важно сохранять адекватную терапию. Распространённый отказ от грудного вскармливания в таком случае не может рассматриваться как оптимальная тактика, поскольку в тех ситуациях, где риски для ребёнка не велики, польза кормления грудью бесспорна как для ребёнка, так и для матери. Для ребёнка это снижение риска сахарного диабета, ожирения, инфекционных осложнений [13]; улучшение показателей нервно-психического развития в будущем [14]. Сохранение грудного вскармливания является и для женщины одним из факторов, предотвращающих развитие послеродовой депрессии, одновременно с этим выраженность депрессии оказывает влияние на становление лактации и продолжение кормления грудью [15]. Таким образом, сохранение грудноговскармливания на фоне адекватной терапии антидепрессантами является оптимальной для здоровья матери и ребёнка тактикой. Важно быть уверенными в том, чтобы колебания концентраций препарата во время беременности были минимальными, при этом степень проникновения лекарства к организму плода и новорождённого была незначительной.
В настоящей статье мы ставили целью сопоставить стабильность фармакокинетики разных представителей группы СИОЗС у беременных и кормящих.
Материалы и методы / Materials and methods
Проведён анализ данных о метаболизме зарегистрированных в России представителей СИОЗС, имеющихся данных о возможных изменениях метаболизма во время беременности, имеющихся данных о фармакокинетике препаратов в период лактации. Проведён литературный поиск в период до мая 2022 г. в информационной базе PubMed, E-library, а также теоретический анализ баз данных о метаболизме и фармакокинетике представителей СИОЗС DrugBank, PharmGKB, Pharm Var; базы данных о фармакокинетике лекарств при грудном вскармливании Lactmed.
Литературный поиск осуществлялся по ключевым словам: Selective serotonine reuptake inhibitors AND (pregnancy OR breast feeding); (pharmacokinetics OR pharmacogenetics) AND pregnancy. Также использовали подобную структуру поиска с указанием отдельных представителей СИОЗС.
Результаты / Results
Несмотря на скудность доступных научных исследований в этой области, сегодня известно, что активность цитохромов Р450 изменяется во время беременности независимо от прочих причин, таких как воздействие экзогенных индукторов или ингибиторов [16]. Наиболее приемлемым объяснением этому является индукция ферментов метаболизма под влиянием гормонов: кортизола относительно CYP3A4 [17] эстрогена и прогестерона — для этого и многих других изоферментов [18]. Этот факт наряду с генетическими особенностями, определяющими врождённую активность ферментов метаболизма, во многом определяет индивидуальную вариабельность и особенности воздействия СИОЗС во время беременности.
В таблице 1 представлены сведения об изменении активности ферментов метаболизма во время беременности, а также распространённость генетических вариантов крайних изменений скорости метаболизма для ключевых подсемейств цитохромов Р450. Следует отметить, что изменение активности, связанное с беременностью, возможно только для тех вариантов, которые генетически имеют нормальный уровень экспрессии (не являются носителями генетических вариантов медленного или быстрого метаболизма).
Таблица 1
Факторы, влияющие на индивидуальную активность подсемейств цитохромов Р450 у беременных
Table 1
Factors affecting the individual activity of cytochrome P450 subfamilies in pregnant women
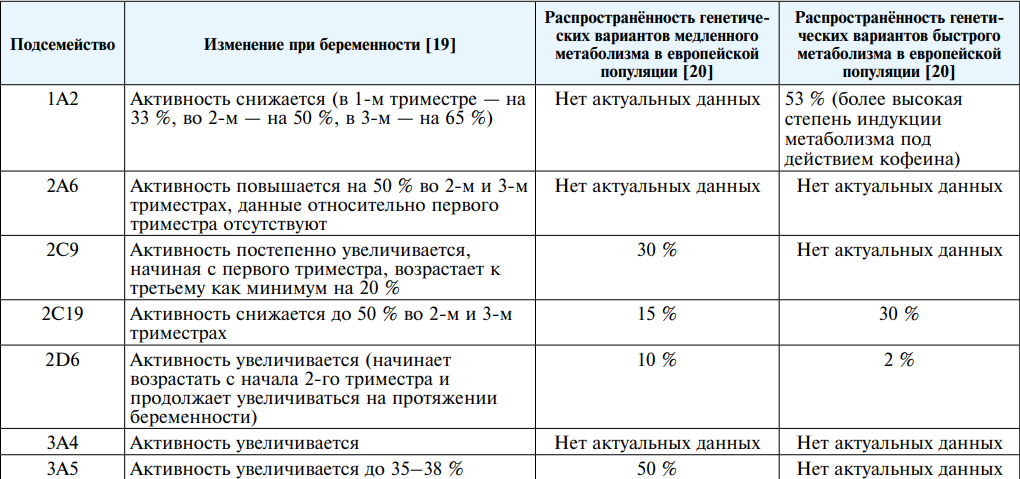
Следует отметить, что и цитохромы, и уридин дифосфат глюкуронозил трансфераза (UGT) присутствуют в организме плода, хотя и в существенно меньших количествах, чем в организме матери. Преобладающим в организме плода является «фетальный» вариант цитохромов CYP3A7, в небольшом количестве экспрессируется CYP3A4. Активность CYP2C9 и CYP2C19 составляет около 1–2 % в фетальном периоде и возрастает до 30 % от активности взрослого организма к моменту родов. Согласно опубликованным данным, в плаценте обнаруживается мРНК цитохромов: CYP1A1, 2E1, 3A4, 3A5, 3A7, 4B1, однако количества этой мРНК очень малы — существенно меньше, чем в печени матери [19]. Всё это свидетельствует о том, что, скорее всего, лекарственную экспозицию во время беременности определяет в первую очередь активность материнских цитохромов. Теоретически значимым изменением, сопровождающим беременность, является также снижение содержания альбумина во втором триместре, которое достигает 70–80 % от исходного к моменту родов. Лекарственные средства, имеющие высокую связь с белками плазмы, могут подвергаться более значительному метаболизму, а также более выраженной активности благодаря увеличению несвязанной с белком фракции.
В настоящее время в России зарегистрированы следующие представители СИОЗС: флуоксетин, циталопрам, эсциталопрам, пароксетин, сертралин, флувоксамин. Часто их активность в качестве антидепрессантов считается сопоставимой [21], и особенности фармакокинетики могут иметь решающую роль в выборе одного из представителей группы для фармакотерапии во время беременности.
В таблице 2 обобщена информация о взаимоотношениях зарегистрированных представителей СИОЗС с цитохромами Р450, которые использованы вместе с данными таблицы 1 для формулировки предположений об ожидаемых особенностях фармакокинетики этих препаратов у беременных и кормящих.
Таблица 2
Table 2
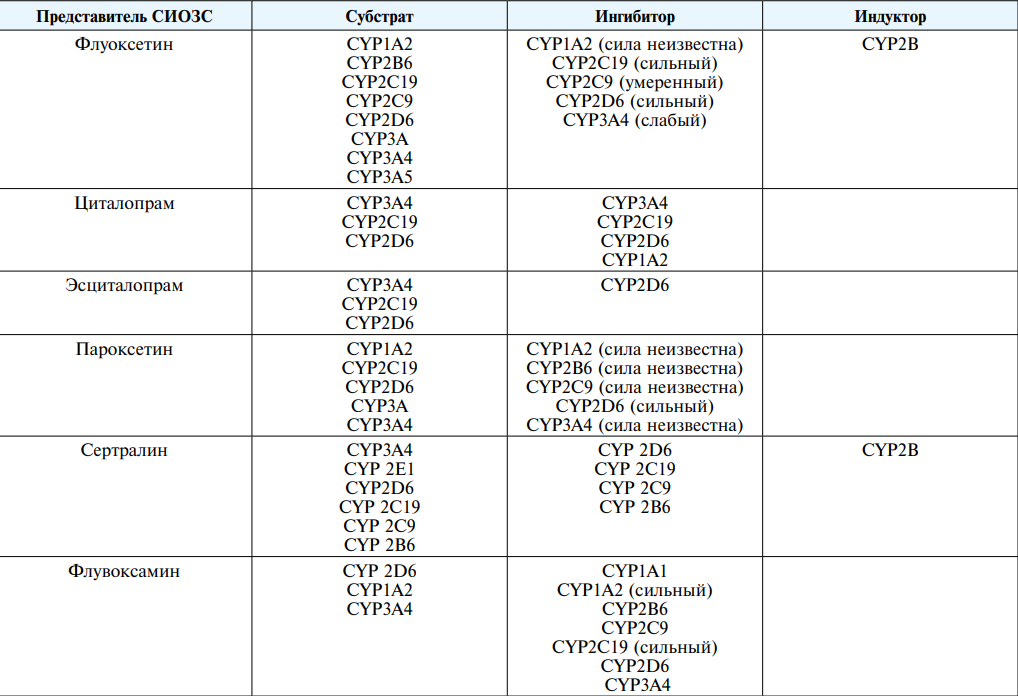
Флуоксетин / Fluoxetine
Флуоксетин характеризуется высокой степенью связи с белками плазмы — около 94 %. Основной метаболит — норфлуоксетин — обладает фармакологической активностью [22].
Фармакокинетика у беременных / Pharmacokinetics in pregnant women. Метаболизм флуоксетина характеризуется стереоселективностью. Несмотря на то что в превращении флуоксетина в норфлуоксетин принимает участие множество ферментов: CYP1A2, 2B6, 2C9, 2C19, 2D6, 3A4, 3A5, — основное значение имеют CYP2D6, CYP2C9 и CYP3A4 [22]. При этом S-флуоксетин метаболизируется, в основном, посредством CYP2D6, а R-флуоксетин — CYP2C9. В одном из исследований было показано, что во втором и третьем триместре концентрации активных компонентов сни-жаются на 32 %. В другом исследовании статистически значимых изменений фармакокинетики совокупности исходного вещества и активного метаболита обнаружено не было, т. о., благодаря наличию фармакологической активности у метаболита, в целом можно считать, что беременность, а также и генетический полиморфизм не оказывают значительного влияния на активную часть (флуоксетин + норфлуоксетин) [].
Учитывая ингибирование активности CYP2D6 и CYP2C19 под влиянием флуоксетина следует ожидать увеличения концентраций и клинического эффекта ряда бета-адреноблокаторов, других психотропных лекарственных средств, метаболизирующихся в системе CYP2D6, а также субстратов CYP2C19 — ингибиторов протонной помпы, клопидогрела, ряда психотропных лекарственных средств.
Концентрации у новорождённых / Concentrations in newborns. По результатам исследований в грудном молоке определяется 3–12 % от скорректированной на массу тела дозы матери. При определении концентрации флуоксетина у младенцев на грудном вскармливании было обнаружено, что концентрация его в плазме крови составляла 7 % от материнской (от нуля до 59 %). Активный метаболит норфлуоксетин обнаруживается в сыворотке младенцев, находящихся на грудном вскармливании, в течение первых 2 месяцев после родов в количестве, соответствующем 38 % от концентраций в плазме крове матери [24].
Циталопрам / Citalopram
Циталопрам и его метаболиты — десметилциталопрам и дидеметилциталопрам связаны с белками плазмы на 80 %.
Основной метаболит — N-десметилциталопрам (образуется с помощью цитохромов CYP2C19, CYP3A4) — малоактивен; остальные метаболиты: дидеметилциталопрам (CYP2D6) и циталопрам N-оксид (моноаминоксидаза, альдегидоксидаза) — также обладают низкой фармакологической активностью [25].
Таким образом, изменения активности цитохромов во время беременности могут затронуть концентрации исходного вещества разнонаправленно (снижение активности CYP2C19 и повышение — CYP3A4), что, по нашему мнению, не должно привести к существенному изменению результирующего эффекта.
Фармакокинетика у беременных / Pharmacokinetics in pregnant women. В исследовании Sit DK с соавторами было продемонстрировано значимое снижение концентраций право- и левовращающих форм циталопрама по мере прогрессирования беременности, сопровождающееся уменьшением контроля над симптомами депрессии. В послеродовом периоде отмечено увеличение концентраций препарата. Эти данные подтверждаются норвежскими авторами, которые отметили, что концентрации циталопрама в 3-м триместре были на 24 % ниже, чем в первом [23]. Авторы метаанализа, опубликованного в 2020 году, подсчитали, что к третьему триместру ожидается снижение концентраций до 70 % от исходного, но предупредили, что общее выраженное снижение концентрации циталопрама не обязательно должно приводить к изменению эффекта, т. к., по некоторым сведениям, снижение общей концентрации в основном происходит за счёт фармакологически неактивного R-стереоизомера, который метаболизируется с помощью CYP2D6, а фармакологически активный S-стереоизомер метаболизируется с помощью CYP2C19, активность которого несколько снижается во время беременности [27]. Однозначных выводов сделать невозможно, т. к. данные разных исследователей разнятся, но, вероятно, повышать дозы циталопрама для всех женщин к третьему триместру не целесообразно.
Циталопрам может увеличивать концентрации субстратов CYP3A4, CYP2D6 и CYP2C19, создавая риск лекарственных взаимодействий, что следует учитывать при выборе этого представителя группы.
Концентрации у новорождённых / Concentrations in newborns. Согласно данным опубликованных исследований, в грудном молоке накопится такое количество циталопрама, которое будет соответствовать 7,9 % материнской концентрации в пересчёте на массу тела [24]. У детей, находящихся на грудном вскармливании, в плазме крови концентрации циталопрама соответствуют 3–7 % от материнских.
Эсциталопрам / Escitalopram
Препарат является левовращающим стереоизомером циталопрама.
Согласно данным производителя, основной метаболит — десметилциталопрам (малоактивен). В метаболизме основную роль играет CYP2C19.
Фармакокинетика у беременных / Pharmacokinetics in pregnant women. В исследовании Westin AA с соавторами концентрации эсциталопрама значимо не изменялись в третьем триместре по сравнению с первым, аналогичные результаты получены Sit DK с соавторами. Вероятно, это связано с разнонаправленными изменениями активности CYP2C19 и CYP3A4 во время беременности [23][26]. Данные метаанализа опубликованных исследований фармакокинетики говорят о незначительном (на 10 %) повышении концентраций эсциталопрама в третьем триместре беременности [27]. Препарат ингибирует CYP2D6, что теоретически может привести к повышению концентраций субстратов этого цитохрома, некоторые из которых могут применять женщины во время беременности.
Концентрации у новорождённых / Concentrations in newborns. В исследовании Rampono J с соавторами на основании данных о концентрациях эсциталопрама и десметилциталопрама было рассчитано, что ребёнок, находящийся на полном грудном вскармливании, получит 3,7 % от материнской дозы в пересчёте на килограмм массы тела [28][29]
Пароксетин / Paroxetine
Пароксетин связан с белками плазмы крови на 95 %. Его метаболизм осуществляется в основном с помощью изофермента CYP2D6 при некотором участии CYP3A4 и, возможно, других цитохромов [30]. Формирующиеся метаболиты не обладают фармакологической активностью.
Фармакокинетика у беременных / Pharmacokinetics in pregnant women. Индивидуальная активность пароксетина во многом определяется активностью CYP2D6 [31], и в случаях, когда терапию инициируют уже во время беременности, носительницы мутаций, определяющих медленный метаболизм, будут подвержены большему воздействию пароксетина, а обладательницы быстрого метаболизма — напротив, могут не получить должного эффекта при назначении традиционных доз. Исследователи описывают снижение концентраций пароксетина приблизительно на 0,3 мкг/л/неделю, что обусловлено повышением активности CYP2D6 во время беременности. При этом у носительниц генотипа медленного метаболизма, напротив, отмечается не менее значимое возрастание концентраций пароксетина к третьему триместру (на 0,8 мкг/л/неделю). Авторы исследования объясняют это наличием конкурентного антагонизма между пароксетином и эндогенными субстратами CYP2D6, концентрации которых могут возрастать во время беременности [32]. Различий в баллах, определяющих выраженность тревожно-депрессивного расстройства, между носительницами разных генотипов CYP2D6 исследователи не обнаружили, хотя у всех женщин отмечалось значительное увеличение выраженности эмоционального расстройства к завершению беременности, что подчёркивает необходимость назначения достаточных доз антидепрессантов. Таким образом, в индивидуальном воздействии пароксетина при беременности принципиальное значение имеет генетически предопределённая активность CYP2D6. Пароксетин является не только субстратом, но и сильным ингибитором CYP2D6 [33]. Это следует учитывать при одновременном назначении других субстратов этого цитохрома.
Концентрации у новорождённых / Concentrations in newborns. Как для большинства лекарственных средств, количество наблюдений концентраций пароксетина у кормящих очень мало. Известно, что пароксетин проникает в грудное молоко, и, исходя из концентраций, которые он создаёт в молоке, ребёнок, находящийся на полном грудном вскармливании, может получить от 1,2 до 1,4 % от материнской дозы в пересчёте на массу тела. При этом ни у одного из детей пароксетин в кровотоке или его побочные эффекты не определялись [34]. В обобщённом анализе 40 случаев грудного вскармливания на фоне приёма пароксетина в интервале доз от 10 до 50 мг также не было обнаружено определимых концентраций пароксетина в образцах крови, взятых у детей [24]. Был описан один случай, когда и мать, и новорождённый были носителями генотипа медленного метаболизма CYP2D6 — мать принимала пароксетин в дозе 20 мг в сутки, и даже в этом случае пароксетин в крови у ребёнка не определялся [34].
Сертралин / Sertraline
Сертралин характеризуется очень высокой степенью связи с белками плазмы крови (98–99 %) что в теории может делать его эффекты чувствительными к изменению содержания белка. Сертралин подвергается интенсивному метаболизму в печени с образованием одного основного метаболита — N-десметилсертралина (норсертралина), обладающего существенно меньшей фармакологической активностью [35]. Основную роль в метаболизме сертралина играют CYP3A4 и CYP2B6 с некоторым участием CYP2C19 и CYP2D6.
Фармакокинетика при беременности / Pharmacokinetics during pregnancy. По результатам опубликованных исследований был сделан вывод о том, что концентрации сертралина увеличиваются на 10 % в 1-м триместре, на 36 % во втором триместре и на 68 % в третьем [23]. Причины такого изменения концентраций не вполне ясны. Учитывая особенности изменения активности ферментов во время беременности, авторы делают вывод о том, что из всего множества ферментов, принимающих участие в метаболизме сертралина, принципиальное значение в увеличении концентраций имеет снижение активности CYP2C19. Можно предположить, что у пациенток с генетически сниженной активностью CYP2C19 изменения концентраций будут противоположными и будут обусловлены увеличением активности других ферментов. Опубликованные к настоящему времени данные [36] говорят о том, что наблюдаемые изменения концентраций сертралина во время беременности не ассоциированы с клинически значимыми последствиями — изменением эффективности терапии или появлением побочных эффектов, что связано с широким диапазоном терапевтических концентраций и общей низкой токсичностью этого представителя группы СИОЗС. В проспективном исследовании 16 женщин, которые получали сертралин во время беременности, наблюдали ожидаемую тенденцию к увеличению концентраций, сопровождающуюся большой межиндивидуальной вариабельностью (в 10 раз). Сертралин проникал в кровоток плода в концентрациях, существенно меньших, чем в плазме матери — около 30 % [36].
Концентрации у новорождённых / Concentrations in newborns. Сертралин, как и другие представители СИОЗС, проникает в грудное молоко. По результатам определения концентраций сертралина в грудном молоке ребёнок, находящийся на полном грудном вскармливании, получит около 0,9 % от материнской дозы в пересчёте на массу тела [34]. В совокупном анализе данных, полученных от 53 кормящих матерей, получающих сертралин, оказалось, что в плазме крови детей, находящихся на грудном вскармливании, обнаруживается от 0 до 15 % (в среднем 2 %) от материнской концентрации сертралина. В 3 случаях определялись концентрации более 10 % от материнских, что расценивалось как повышенные концентрации [24]. У некоторых детей вместо концентраций сертралина обнаруживался его метаболит норсертралин [37].
Флувоксамин / Fluvoxamine
Флувоксамин связан с белками плазмы крови на 80 %. В ходе метаболизма образуются около 9 метаболитов. Основные ферменты, участвующие в метаболизме, — CYP1A2 и CYP2D6. Фармакологическая активность не известна.
Фармакокинетика при беременности / Pharmacokinetics during pregnancy. Активность двух подсемейств цитохромов, принимающих участие в метаболизме флувоксамина, меняется во время беременности разнонаправленно: активность CYP2D6 повышается, CYP1A2 — снижается. Это позволяло предположить, что разнонаправленные изменения компенсируют друг друга. Однако в проспективном наблюдении 3 беременностей было показано, что концентрации флувоксамина снижаются в 3-м триместре на 56 % от исходных значений. Это говорит о том, что, вероятно, преобладающее значение имеет индукция CYP2D6 [23].
Концентрации у новорождённых / Concentrations in newborns. На основании единичных опубликованных данных о концентрациях флувоксамина в грудном молоке исследователи подсчитали, что ребёнок, находящийся на полном грудном вскармливании, получит 0,98 % от материнской дозы в пересчёте на килограмм массы тела [24][38]. В результате измерения концентраций флувоксамина у четверых детей на грудном вскармливании на фоне применения матерью флувоксамина в дозе 100–150 мг/сутки концентрации флувоксамина были не определимы [39]. В другом наблюдении трёх младенцев в их кровотоке концентрации флувоксамина составляли от 0 до 45 % от материнских [40].
Обсуждение / Discussion
Во время беременности очень важно поддерживать оптимальные концентрации лекарственных препаратов для достижения стабильного фармакологического ответа. Эта задача существенно осложняется тем, что под влиянием изменений гормонального фона меняется эмоциональный статус женщины, а физиологические изменения приводят к изменению концентраций препаратов. Как правило, фармакокинетика лекарственных средств во время беременности остаётся не изученной, данные, на которые можно опереться, очень скудны.
В этой статье мы суммировали имеющиеся данные. В таблице 3 представлена обобщённая информация, основанная на представленных данных.
Таблица 3
Сравнительная характеристика особенностей фармакокинетики СИОЗС при беременности и грудном вскармливании
Table 3
Comparative characteristics of the pharmacokinetics of SSRIs during pregnancy and breastfeeding
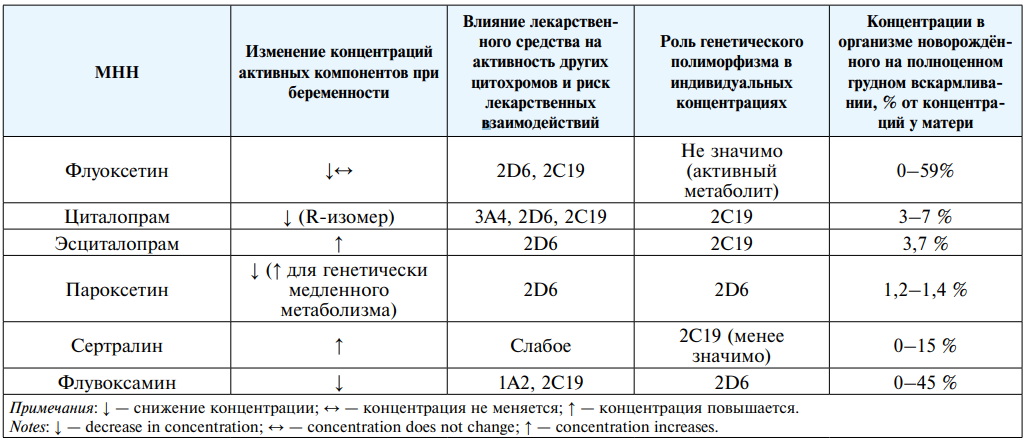
Благодаря широкому терапевтическому интервалу представителей СИОЗС, часто колебания концентраций не приводят к значимым изменениям, однако литературные данные свидетельствуют о возможностичрезмерно высоких концентраций у носительниц генетических вариантов медленного метаболизма и их новорождённых детей или, напротив, низких концентраций к моменту родов, что может поставить под угрозу психическое здоровье женщины и увеличить риск тяжёлых депрессивных расстройств в послеродовом периоде. C точки зрения влияния генетически предопределённых различий в скорости метаболизма антидепрессантов группы СИОЗС, мутации в генах как CYP2C19, так и CYP2D6 достаточно широко распространены в европейской популяции, к которой относится и большая часть населения России. Международный консорциум по клинической интерпретации фармакогенетических исследований (cpicpgx.org) рекомендует на основании опубликованных данных снижение дозы пароксетина и флувоксамина на 50 % в случае выявления генотипов медленного метаболизма в системе CYP2D6 и такое же снижение дозы циталопрама, эсциталопрама и сертралина при выявлении генотипов медленного метаболизма в системе CYP2C19 [41]. Несмотря на то что каждый из представителей СИОЗС характеризуется рядом факторов индивидуальной изменчивости концентраций или возможностью лекарственных взаимодействий, складывается впечатление об относительно больших преимуществах сертралина, который использует множество ферментов для метаболизма, характеризуется низким потенциалом лекарственных взаимодействий и рассматривается рядом авторов как предпочтительный препарат для применения на фоне сохраняющегося грудного вскармливания [42]. Однако это всего лишь теоретические выводы, которые требуют подтверждения в анализе.
Заключение / Conclusion
Применение СИОЗС во время беременности и грудного вскармливания в некоторых клинических ситуациях может стать безальтернативным способом поддержания здоровья и улучшения прогноза для женщины и ребёнка. Все представители СИОЗС характеризуются факторами индивидуальной вариабельности ответа, многие характеризуются разнонаправленными изменениями концентраций в ходе беременности. При выборе того или иного представителя следует учитывать вероятность генетической предрасположенности к более низким или более высоким концентрациям, вероятность одновременного назначения лекарственных средств, метаболизм которых может измениться под действием СИОЗС, а также учитывать ожидаемые изменения концентраций в ходе беременности. Принимая во внимание все эти факторы, можно существенно снизить вероятность как клинической неэффективности терапии, так и повреждающего действия терапии на организм плода и новорождённого. Авторы надеются, что представленная в статье информация поможет врачу и исследователю сориентироваться в опубликованных к настоящему времени данных и их интерпретации
Список литературы
1. Lupattelli A, Spigset O, Björnsdóttir I, Hämeen-Anttila K, Mårdby AC, Panchaud A, Juraski RG, Rudolf G, Odalovic M, Drozd M, Twigg MJ, Juch H, Moretti ME, Kennedy D, Rieutord A, Zagorodnikova K, Passier A, Nordeng H. Patterns and factors associated with low adherence to psychotropic medications during pregnancy—a cross-sectional, multinational web-based study. Depress Anxiety. 2015 Jun;32(6):426–436. DOI: 10.1002/da.22352
2. Babicki M, Kowalski K, Bogudzińska B, Mastalerz-Migas A. Impact of the COVID-19 Pandemic on Mental Well-Being. A Nationwide Online Survey Covering Three Pandemic Waves in Poland. Front Psychiatry. 2021 Dec 17;12:804123. DOI: 10.3389/fpsyt.2021.804123
3. Kahyaoglu Sut H, Kucukkaya B. Anxiety, depression, and related factors in pregnant women during the COVID-19 pandemic in Turkey: A web-based cross-sectional study. Perspect Psychiatr Care. 2021 Apr;57(2):860–868. DOI: 10.1111/ppc.12627
4. Anderson KN, Lind JN, Simeone RM, Bobo WV, Mitchell AA, Riehle- Colarusso T, Polen KN, Reefhuis J. Maternal Use of Specific Antidepressant Medications During Early Pregnancy and the Risk of Selected Birth Defects. JAMA Psychiatry. 2020 Dec 1;77(12):1246–1255. DOI: 10.1001/ jamapsychiatry.2020.2453
5. Nagel EM, Howland MA, Pando C, Stang J, Mason SM, Fields DA, Demerath EW. Maternal Psychological Distress and Lactation and Breastfeeding Outcomes: a Narrative Review. Clin Ther. 2022 Feb;44(2):215– 227. DOI: 10.1016/j.clinthera.2021.11.007
6. Farewell CV, Donohoe R, Thayer Z, Paulson J, Nicklas J, Walker C, Waldie K, Leiferman JA. Maternal depression trajectories and child BMI in a multi-ethnic sample: a latent growth modeling analysis. BMC Pregnancy Childbirth. 2021 Dec 13;21(1):827. DOI: 10.1186/s12884-021-04308-0
7. Shigemi D, Ishimaru M, Matsui H, Fushimi K, Yasunaga H. Suicide Attempts Among Pregnant and Postpartum Women in Japan: A Nationwide Retrospective Cohort Study. J Clin Psychiatry. 2020 May 5;81(3):19m12993. DOI: 10.4088/JCP.19m12993
8. De Vries C, Gadzhanova S, Sykes MJ, Ward M, Roughead E. A Systematic Review and Meta-Analysis Considering the Risk for Congenital Heart Defects of Antidepressant Classes and Individual Antidepressants. Drug Saf. 2021 Mar;44(3):291–312. DOI: 10.1007/s40264-020-01027-x
9. Koren G, Berkovitch M, Ornoy A. Dose-Dependent Teratology in Humans: Clinical Implications for Prevention. Paediatr Drugs. 2018 Aug;20(4):331–335. DOI: 10.1007/s40272-018-0294-0
10. Bandoli G, Chambers CD, Wells A, Palmsten K. Prenatal Antidepressant Use and Risk of Adverse Neonatal Outcomes. Pediatrics. 2020 Jul;146(1):e20192493. DOI: 10.1542/peds.2019-2493
11. Ellfolk M, Malm H. Risks associated with in utero and lactation exposure to selective serotonin reuptake inhibitors (SSRIs). Reprod Toxicol. 2010 Sep;30(2):249–60. DOI: 10.1016/j.reprotox.2010.04.015
12. Andrade C. Selective Serotonin Reuptake Inhibitor Use in Pregnancy and Risk of Postpartum Hemorrhage. J Clin Psychiatry. 2022 Apr 4;83(2):22f14455. DOI: 10.4088/JCP.22f14455
13. Michaelsen KF. 2.1 Breastfeeding. World Rev Nutr Diet. 2022;124:133– 138. DOI: 10.1159/000516700
14. Horta BL, de Sousa BA, de Mola CL. Breastfeeding and neurodevelopmental outcomes. Curr Opin Clin Nutr Metab Care. 2018 May;21(3):174–178. DOI: 10.1097/MCO.0000000000000453
15. Franco-Antonio C, Santano-Mogena E, Chimento-Díaz S, Sánchez- García P, Cordovilla-Guardia S. A randomised controlled trial evaluating the effect of a brief motivational intervention to promote breastfeeding in postpartum depression. Sci Rep. 2022 Jan 10;12(1):373. DOI: 10.1038/ s41598-021-04338-w
16. Pariente G, Leibson T, Carls A, Adams-Webber T, Ito S, Koren G. Pregnancy-Associated Changes in Pharmacokinetics: A Systematic Review. PLoS Med. 2016 Nov 1;13(11):e1002160. DOI: 10.1371/journal.pmed.1002160
17. Zhang Z, Farooq M, Prasad B, Grepper S, Unadkat JD. Prediction of gestational age-dependent induction of in vivo hepatic CYP3A activity based on HepaRG cells and human hepatocytes. Drug Metab Dispos. 2015 Jun;43(6):836–842. DOI: 10.1124/dmd.114.062984
18. Choi SY, Koh KH, Jeong H. Isoform-specific regulation of cytochromes P450 expression by estradiol and progesterone. Drug Metab Dispos. 2013 Feb;41(2):263–269. DOI: 10.1124/dmd.112.046276
19. Anderson GD. Pregnancy-induced changes in pharmacokinetics: a mechanistic-based approach. Clin Pharmacokinet. 2005;44(10):989–1008. DOI: 10.2165/00003088-200544100-00001
20. PharmVar [Internet] [cited 2022 May 1]. Available from: https://www. pharmvar.org/.
21. Cipriani A, Furukawa TA, Salanti G, Chaimani A, Atkinson LZ, Ogawa Y, Leucht S, Ruhe HG, Turner EH, Higgins JPT, Egger M, Takeshima N, Hayasaka Y, Imai H, Shinohara K, Tajika A, Ioannidis JPA, Geddes JR. Comparative efficacy and acceptability of 21 antidepressant drugs for the acute treatment of adults with major depressive disorder: a systematic review and network meta-analysis. Lancet. 2018 Apr 7;391(10128):1357–1366. DOI: 10.1016/S0140-6736(17)32802-7
22. Margolis JM, O’Donnell JP, Mankowski DC, Ekins S, Obach RS. (R)-, (S)-, and racemic fluoxetine N-demethylation by human cytochrome P450 enzymes. Drug Metab Dispos. 2000 Oct;28(10):1187–1191.
23. Westin AA, Brekke M, Molden E, Skogvoll E, Spigset O. Selective serotonin reuptake inhibitors and venlafaxine in pregnancy: Changes in drug disposition. PLoS One. 2017 Jul 14;12(7):e0181082. DOI: 10.1371/journal. pone.0181082. Erratum in: PLoS One. 2018 Jan 16;13(1):e0191508.
24. Weissman AM, Levy BT, Hartz AJ, Bentler S, Donohue M, Ellingrod VL, Wisner KL. Pooled analysis of antidepressant levels in lactating mothers, breast milk, and nursing infants. Am J Psychiatry. 2004 Jun;161(6):1066–1078. DOI: 10.1176/appi.ajp.161.6.1066
25. Bezchlibnyk-Butler K, Aleksic I, Kennedy SH. Citalopram—a review of pharmacological and clinical effects. J Psychiatry Neurosci. 2000 May;25(3):241–254.
26. Sit DK, Perel JM, Helsel JC, Wisner KL. Changes in antidepressant metabolism and dosing across pregnancy and early postpartum. J Clin Psychiatry. 2008 Apr;69(4):652–658. DOI: 10.4088/jcp.v69n0419
27. Schoretsanitis G, Spigset O, Stingl JC, Deligiannidis KM, Paulzen M, Westin AA. The impact of pregnancy on the pharmacokinetics of antidepressants: a systematic critical review and meta-analysis. Expert Opin Drug Metab Toxicol. 2020 May;16(5):431–440. DOI: 10.1080/17425255.2020.1750598
28. Rampono J, Hackett LP, Kristensen JH, Kohan R, Page-Sharp M, Ilett KF. Transfer of escitalopram and its metabolite demethylescitalopram into breastmilk. Br J Clin Pharmacol. 2006 Sep;62(3):316–322. DOI: 10.1111/j.1365-2125.2006.02659.x
29. Castberg I, Spigset O. Excretion of escitalopram in breast milk. J Clin Psychopharmacol. 2006 Oct;26(5):536–538. DOI: 10.1097/01. jcp.0000231607.45402.b4
30. Foster RH, Goa KL. Paroxetine : a review of its pharmacology and therapeutic potential in the management of panic disorder. CNS Drugs. 1997 Aug;8(2):163–188. DOI: 10.2165/00023210-199708020-00010
31. Goryachkina K, Burbello A, Boldueva S, Babak S, Bergman U, Bertilsson L. CYP2D6 is a major determinant of metoprolol disposition and effects in hospitalized Russian patients treated for acute myocardial infarction. Eur J Clin Pharmacol. 2008 Dec;64(12):1163–1173. DOI: 10.1007/s00228- 008-0525-3
32. Ververs FF, Voorbij HA, Zwarts P, Belitser SV, Egberts TC, Visser GH, Schobben AF. Effect of cytochrome P450 2D6 genotype on maternal paroxetine plasma concentrations during pregnancy. Clin Pharmacokinet. 2009;48(10):677–683. DOI: 10.2165/11318050-000000000-00000
33. Goryachkina K, Burbello A, Boldueva S, Babak S, Bergman U, Bertilsson L. Inhibition of metoprolol metabolism and potentiation of its effects by paroxetine in routinely treated patients with acute myocardial infarction (AMI). Eur J Clin Pharmacol. 2008 Mar;64(3):275–282. DOI: 10.1007/s00228-007-0404-3
34. Berle JØ, Steen VM, Aamo TO, Breilid H, Zahlsen K, Spigset O. Breastfeeding during maternal antidepressant treatment with serotonin reuptake inhibitors: infant exposure, clinical symptoms, and cytochrome p450 genotypes. J Clin Psychiatry. 2004 Sep;65(9):1228–1234. DOI: 10.4088/ jcp.v65n0911
35. DeVane CL, Liston HL, Markowitz JS. Clinical pharmacokinetics of sertraline. Clin Pharmacokinet. 2002;41(15):1247–1266. DOI: 10.2165/00003088-200241150-00002
36. Heinonen E, Blennow M, Blomdahl-Wetterholm M, Hovstadius M, Nasiell J, Pohanka A, Gustafsson LL, Wide K. Sertraline concentrations in pregnant women are steady and the drug transfer to their infants is low. Eur J Clin Pharmacol. 2021 Sep;77(9):1323–1331. DOI: 10.1007/s00228-021- 03122-z
37. Pinheiro E, Bogen DL, Hoxha D, Ciolino JD, Wisner KL. Sertraline and breastfeeding: review and meta-analysis. Arch Womens Ment Health. 2015 Apr;18(2):139–146. DOI: 10.1007/s00737-015-0499-y
38. Kristensen JH, Hackett LP, Kohan R, Paech M, Ilett KF. The amount of fluvoxamine in milk is unlikely to be a cause of adverse effects in breastfed infants. J Hum Lact. 2002 May;18(2):139–143. DOI: 10.1177/089033440201800205
39. Hendrick V, Fukuchi A, Altshuler L, Widawski M, Wertheimer A, Brunhuber MV. Use of sertraline, paroxetine and fluvoxamine by nursing women. Br J Psychiatry. 2001 Aug;179:163–166. DOI: 10.1192/bjp.179.2.163
40. Arnold LM, Suckow RF, Lichtenstein PK. Fluvoxamine concentrations in breast milk and in maternal and infant sera. J Clin Psychopharmacol. 2000 Aug;20(4):491–493. DOI: 10.1097/00004714-200008000-00018
41. Hicks JK, Stowe D, Willner MA, Wai M, Daly T, Gordon SM, Lashner BA, Parikh S, White R, Teng K, Moss T, Erwin A, Chalmers J, Eng C, Knoer S. Implementation of Clinical Pharmacogenomics within a Large Health System: From Electronic Health Record Decision Support to Consultation Services. Pharmacotherapy. 2016 Aug;36(8):940–948. DOI: 10.1002/phar.1786
42. Larsen ER, Damkier P, Pedersen LH, Fenger-Gron J, Mikkelsen RL, Nielsen RE, Linde VJ, Knudsen HE, Skaarup L, Videbech P; Danish Psychiatric Society; Danish Society of Obstetrics and Gynecology; Danish Paediatric Society; Danish Society of Clinical Pharmacology. Use of psychotropic drugs during pregnancy and breast-feeding. Acta Psychiatr Scand Suppl. 2015;(445):1–28. DOI: 10.1111/acps.12479
Об авторах
К. А. ЗагородниковаРоссия
к. м. н., зав. отделом клинической фармакологии
Санкт-Петербург
С. Ю. Новикова
Россия
студент
Санкт-Петербург
Рецензия
Для цитирования:
Загородникова К.А., Новикова С.Ю. Генетические и физиологические предпосылки к индивидуальному воздействию селективных ингибиторов обратного захвата серотонина во время беременности и грудного вскармливания. Фармакогенетика и фармакогеномика. 2022;(1):6-14. https://doi.org/10.37489/2588-0527-2022-1-6-14
For citation:
Zagorodnikova K.A., Novikova S.Yu. Genetic and physiological factors predisposing to individual selective serotonine reuptake inhibitors exposure during pregnancy and breast feeding. Pharmacogenetics and Pharmacogenomics. 2022;(1):6-14. (In Russ.) https://doi.org/10.37489/2588-0527-2022-1-6-14











































