Перейти к:
Полиморфизм гена ADRB2 и состояние угрозы преждевременных родов
https://doi.org/10.37489/2588-0527-2021-1-9-17
Аннотация
В данной статье обсуждаются вопросы, связанные с ролью полиморфизма гена ADRB2, кодирующего β2-адренорецептор, при преждевременных родах и токолизе. Приводится информация о научных исследованиях по поиску ассоциаций носительства аллелей и генотипов ADRB2 с состоянием угрозы преждевременных родов, с самопроизвольными преждевременными родами, а также с фармакологическим ответом на токолитическую терапию с помощью β2-адреномиметиков. В хронологическом порядке изложена история открытия взаимосвязи полиморфизма гена ADRB2 с преждевременными родами. По мере появления научных фактов, перед исследователями возникает вопрос: каким образом полиморфизмы гена ADRB2 могут отражаться на физиологических процессах? То есть, влияют ли они посредством изменения первичной структуры рецептора или же посредством изменения уровня экспрессии. В зависимости от ответа на этот вопрос перед фармакогенетиками ставится дальнейшая задача: что изучать – отдельные полиморфизмы или гаплотипы?
Ключевые слова
Для цитирования:
Казаков Р.Е., Чилова Р.А., Акопов К.О., Сокова Е.А. Полиморфизм гена ADRB2 и состояние угрозы преждевременных родов. Фармакогенетика и фармакогеномика. 2021;(1):9-17. https://doi.org/10.37489/2588-0527-2021-1-9-17
For citation:
Kazakov R.E., Chilova R.A., Akopov K.O., Sokova E.A. ADRB2 gene polymorphism and preterm labor. Pharmacogenetics and Pharmacogenomics. 2021;(1):9-17. (In Russ.) https://doi.org/10.37489/2588-0527-2021-1-9-17
Введение / Introduction
Около 5–10 % беременностей заканчиваются преждевременными родами (ПР) [1]. В настоящее время в мире преждевременно рождается около 15 млн детей в год, из которых более миллиона умирает [2]. Частота ПР постоянно увеличивается, не в последнюю очередь за счёт искусственно зачатых многоплодных беременностей [3]. У недоношенных детей могут наблюдаться длительные проблемы со здоровьем, вплоть до пожизненных.
Ассоциация полиморфизма гена ADRB2, кодирующего β2-адренорецепторы (β2-АР), с риском развития угрозы преждевременных родов (УПР), риском ПР, а также с фармакологическим ответом на β2-адреномиметики (применяемые с целью токолиза) изучается уже на протяжении двух десятилетий. Данное направление оказалось достаточно плодотворным, и ряд исследователей показал, что полиморфизм гена ADRB2 влияет как на само состояние УПР, так и на фармакологический эффект β2-адреномиметиков.
Доказательства генетической предрасположенности преждевременных родов / Evidence of genetic predisposition to premature birth
Безусловно, состояние УПР связано со множеством причин. Эпидемиологические исследования выявили такие факторы риска, как [3–5]:
- возраст матери менее 18 или более 35 лет;
- недостаточная или избыточная масса тела беременной;
- низкий рост беременной;
- низкое социально-экономическое положение;
- преэклампсия или эклампсия;
- физический (например, длительное стояние на ногах) и психосоциальный стресс;
- инфекционные процессы (хориоамнионит), бактериальный вагиноз;
- воспалительные процессы;
- аномалии или чрезмерное растяжение матки;
- неправильное предлежание плода;
- патологии развития плода.
Кроме этого, существуют доказательства наличия генетической предрасположенности к УПР и ПР [6].
1. У женщин, имевших ПР в анамнезе, сохраняется повышенный риск данной патологии при повторных родах [7–8].
2. Повышенный риск ПР передаётся по наследству по материнской линии. Так, риск ПР выше у женщин, которые сами родились преждевременно, что однако не относится к родившимся преждевременно мужчинам. Также если одна сестра имеет склонность к ПР, то и у другой сестры риск ПР выше; однако если сестры сводные, то риск у них одинаков только при общей матери, но не при общем отце [7–8]. То есть роль генетики отца ребёнка, по-видимому, невелика, и до сих пор не выявлена [9].
3. Наблюдается расовая предрасположенность к ПР: у негроидной расы ПР встречаются в 2 раза чаще, чем европеоидной расы.
4. Близнецовый анализ позволил определить уровень наследуемости ПР, оказавшийся в пределах 17–40 % [9–11]. Суть метода заключается в определении достоверных различий ПР у разнояйцевых близнецов (генетически разнородных) и однояйцевых (генетически идентичных).
5. Полногеномный поиск ассоциаций (GWAS) [12] и исследования по типу «случай–контроль» позволили выявить ряд генетических факторов, ассоциированных с ПР.
Ген β2-адренорецепторов ADRB2: аллели и гаплотипы / β2-adrenergic receptor gene ADRB2: alleles and haplotypes
При действии адреналина или его агонистов на β2-АР происходит релаксация клеток гладкой мускулатуры, чем объясняют основной эффект бронхолитиков короткого действия, вызывающих расширение бронхиол, а также токолитическое действие β2-адреномиметиков, снижающих тонус матки.
В гене ADRB2, кодирующем β2-АР, выявлено более 250 полиморфизмов, наиболее изучены из которых rs1042713 (Gly16Arg), rs1042714 (Gln27Glu) и rs1800888 (Thr164Ile) [13]. Установлено, что полиморфизмы Gly16Arg и Gln27Glu влияют на функцию β2-АР. Было показано, что они связаны с повышенным риском бронхиальной астмы, сахарного диабета и гипертонии [14–16]. Также выявлены ассоциации полиморфизмов гена ADRB2 с аутизмом, детским церебральным параличом (ДЦП), ревматоидным артритом и др. [17]
В исследованиях in vitro было показано, что аллель 16Gly связан с усиленным подавлением агонистами (увеличивает десенсибилизацию), аллель 27Glu – со сниженной регуляцией (снижает чувствительность к подавлению регуляции), 164Ile – с нарушением связывания агонистов и снижением активации аденилциклазы. При этом аминокислота в положении 16 оказывает доминирующее влияние на фенотип. Помимо этих трёх полиморфизмов, функциональные варианты были выявлены также в промоторной области гена [17–19].
На протяжении ряда лет ведётся дискуссия, что имеет физиологическое значение: отдельные полиморфизмы, ведущие к аминокислотной замене, или гаплотип, обладающий определёнными особенностями регуляторных последовательностей, что обусловливает индивидуальный уровень экспрессии. Есть мнение, что биологический и терапевтический фенотип формируется уникальным взаимодействием нескольких полиморфизмов внутри гаплотипа [20]. Однако далее мы убедимся, что многие ассоциации были установлены при определении единичных полиморфизмов. По-видимому, оба подхода имеют право на существование.
При изучении гаплотипов было обнаружено, что 13 однонуклеотидных полиморфизмов организованы в 12 гаплотипов из теоретически возможных 8192 комбинаций [20]. Тем самым, данные полиморфизмы редко образуют новые сочетания с помощью кроссинговера, или же есть какие-то сочетания, элиминирующиеся в процессе естественного отбора.
Установлено, что частоты встречаемости гаплотипов сильно различаются у представителей разных этнических групп (рис. 1).

Рис. 1. Гаплотипы гена ADRB2 и частоты их встречаемости у представителей различных этнических групп [20, с адаптацией]:
Обозначения: Евр – европейцы; Афр – африканцы; Азия – азиаты; Лат –латиноамериканцы.
Figure 1. Haplotypes of the ADRB2 gene and the frequency of their occurrence in representatives of various ethnic groups [20, with adaptation]:
Designations: Евр (Eur) – Europeans; Афр (Afr) – Africans; Азия (Asia) – Asians; Лат (Latin) – Latin Americans.
Открытие ассоциации полиморфизма гена ADRB2 с состоянием угрозы преждевременных родов / Discovery of the association of polymorphism of the ADRB2 gene with the threat of premature birth
Впервые ассоциация полиморфизма гена ADRB2 с частотой ПР была обнаружена Landau R et al. в 2002 г. [19]. В основную группу данного исследования вошли 28 женщин латиноамериканского происхождения, с одноплодной беременностью, без хориоамнионита, пороков развития матки, плаценты или плода, без вредных привычек. Авторы не разделяли ПР на «ранние» и «поздние», считая все роды до 37 недель преждевременными. Группа была неоднородной по токолитической терапии: женщины с ПР могли не лечиться от УПР или же принимать β2-адреномиметик тербуталин и/или сульфат магния. Контрольная группа включала здоровых женщин, родивших в срок и не имевших ПР при предшествующей беременности (n = 251). На этой, скромной по размерам основной группы, выборке было обнаружено достоверное различие в распределении генотипов между родильницами контрольной группы и родившими преждевременно: генотип 16Arg/Arg у женщин с ПР составил 31 % (79 из 251), а у женщин контрольной группы только 4 % (1 из 28) (р < 0,01)! Риск ПР у носительниц гомозиготного генотипа 16Arg/Arg оказался в 12,4 раза меньше, чем у носительниц двух других генотипов: ОШ = 0,08; 95 % ДИ 0,01–0,58 (ОШ — отношение шансов; 95 % ДИ — доверительный интервал). Частота встречаемости аллеля 16Arg была достоверно меньше у женщин с ПР, чем в контрольной группе (29 и 50 %, соответственно, р = 0,002). Ассоциации между ПР и полиморфизмом Gln27Glu обнаружено не было [19].
Каким образом можно объяснить существование связи между β2-АР и ПР? По логике авторов, повышение функциональной активности β2-АР ведёт к меньшей сократительной активности матки в ответ на различные инфекционные, воспалительные или механические раздражители, которые могут обусловливать ПР. То есть полиморфизм гена ADRB2 не является причиной ПР, но может снижать чувствительность гладкой мускулатуры на различные агенты, изменяя тем самым тонус матки [19]. Однако возможны и другие механизмы. В частности, известно, что β2-АР участвуют в иммунном ответе организма, и что натуральные киллеры и некоторые Т-клетки в децидуальной оболочке, защищающие организм матери от вторжения фетальных клеток, несут высокую плотность β2-АР [21–22].
Отдельный вопрос заключается в понимании способов влияния полиморфизмов гена ADRB2 на физиологию β2-АР. Одним из механизмов может быть ассоциация полиморфизмов гена с экспрессией. Panebra A et al. изучили экспрессию 8 наиболее распространённых гаплотипов гена ADRB2, включающих 26 полиморфизмов. Эти гаплотипы были клонированы в экспрессионную конструкцию без векторного промотора, так что экспрессия β2-АР управлялась собственным промотором гена. Трансфекцию осуществляли в клетки COS-7. В результате было показано, что 4 гаплотипа гена характеризуются повышенной экспрессией β2-АР, в 3 из которых был аргинин в положении 16 [23]. Тем не менее, различия в экспрессии гаплотипов могут быть одним из объяснений межиндивидуальных различий, поскольку физиологические процессы также могут зависеть от первичной структуры рецептора.
В 2002 г., практически одновременно с работой Landau R et al., была опубликована статья исследователей из Турции, в которой была поставлена аналогичная задача, — осуществить поиск ассоциации между полиморфизмами Gly16Arg и Gln27Glu гена ADRB2 и ПР, – но с другими результатами. В данное исследование было включено 80 родильниц с ПР (21–36 недель); контрольную группу составляли 76 родильниц, родивших в срок более 37 недель. Все женщины с УПР принимали нифедипин или β2-адреномиметики. В результате авторы обнаружили наличие ассоциации не с полиморфизмом Gly16Arg гена ADRB2, а с Gln27Glu! Фактором риска ПР было признано носительство у женщин аллеля 27Glu: ОШ = 2,14 (95 % ДИ 1,32–3,46; p = 0,002) [24]. Результаты этого исследования лежат особняком от выводов других исследователей: в настоящее время с состоянием УПР, ПР и фармакологическим ответом на токолитики относящиеся к β2-адреномиметикам, обычно связывают полиморфизм Gly16Arg.
Следом за этими пионерскими работами появилась статья американских авторов Doh K et al. [25]. Дизайн исследования был несколько иным: в работе определяли генотип полиморфизмов Gly16Arg и Gln27Glu гена ADRB2 у 159 пар мать–ребёнок, из которых в 32 случаях произошли ПР. Несмотря на небольшую статистику, был отмечен интересный факт: гомозиготный генотип 16Arg/Arg гена ADRB2 встречался у 20,5 % (26 из 127) матерей родивших в срок и ни у одной (0 из 32) матери со спонтанными ПР (p = 0,002). При этом 75 % (24 из 32) матерей, родивших преждевременно, были гетерозиготами 16Gly/Arg, по сравнению с 46 % (58 из 127) матерей, родивших в срок (p = 0,003). Не было связи между исходом беременности и полиморфизмами Gly16Arg и Gln27Glu у младенцев [25]. В самом деле, создается впечатление, что наиболее важно при изучении причин ПР определять генотип матери, а не ребёнка. Влияние генотипа отца, повидимому, ещё меньше.
Поскольку Doh K et al. обратили внимание на неравновесное сцепление аллелей в кодонах 16 и 27, они также исследовали влияние носительства гаплотипов на ПР [25]. В таблице 1 показаны генотипы матери по обоим полиморфизмам.
Таблица 1
Связь между генотипами полиморфизмов Gly16Arg и Gln27Glu гена ADRB2 матери и спонтанными преждевременными родами [25, с адаптацией]
Table 1
The relationship between the genotypes of polymorphisms Gly16Arg and Gln27Glu of the ADRB2 gene of the mother and spontaneous preterm labor [25, with adaptation]

Как можно видеть, у женщин генотип гомозиготный по двум полиморфизмам 16Arg/Arg+27Gln/Gln является протективным, ассоциированным с меньшей вероятностью самопроизвольных ПР (p = 0,04), а генотип 16Gly/Arg+27Gln/Gln — патологичным, ассоциированным с большей частотой ПР (p = 0,01). При этом основным фактором, ассоциированным с ПР, является полиморфизм, связанный с заменой в кодоне 16 [25].
Из работы видно, что ПР в большей степени ассоциированы с полиморфизмом Gly16Arg гена ADRB2, чем с гаплотипами по двум полиморфизмам: Gly16Arg и Gln27Glu.
Открытие влияния полиморфизма гена ADRB2 на токолитическую терапию β2-адреномиметиками / Discovery of the effect of ADRB2 gene polymorphism on tocolytic therapy with β2-adrenomimetics
Известно, что полиморфизм гена ADRB2 может изменять фармакологический ответ лекарственных средств (ЛС), способных влиять на β2-АР. Так, установлено, что у пациентов с астмой, имеющих генотип 16Arg/Arg гена ADRB2, β2 адреномиметик сальбутамол оказывает более сильное и быстрое действие, чем на носителей аллеля 16Gly [26].
В 2005 г. вышла вторая публикация первооткрывателей ассоциации полиморфизма Gly16Arg гена ADRB2 с ПР Landau R et al. [27]. На этот раз исследование было посвящено, прежде всего, влиянию полиморфизма гена ADRB2 на токолиз.
В основную группу исследования были включены 60 родильниц европеоидной расы (венгерки) с УПР, получавших β2-адреномиметик гексопреналин в качестве токолитического препарата по стандартной схеме. Контрольную группу составили 116 родильниц без УПР в анамнезе, родивших в срок. Исключались случаи, когда причины УПР были установлены и были системными (уровень C-реактивного белка >15, количество лейкоцитов >11 000/мм3, температура >38 °C) или местными (инфекции половых путей, многоплодная беременность, сильное вагинальное кровотечение, аномалии матки или шейки матки, предлежание или отслойка плаценты, вредные привычки).
Ответ на токолитическую терапию был удовлетворительным при отсрочивании родов на 48 ч, хорошим — на 7 суток, отличным — до срока более 36 недель. При необходимости проводилось несколько курсов лечения гексопреналином.
Полученные результаты по изучению связи полиморфизмов гена ADRB2 с ПР не вполне совпали с данными 2002 г., полученными на латиноамериканской популяции. Так, обнаруженная ранее ассоциация полиморфизма Gly16Arg гена ADRB2 с исходами (ПР) не была достоверной. Тем не менее, наблюдалась интересная тенденция: у 13 женщин, токолитическая терапия у которых оказалась абсолютно неудачной (роды ранее 48 ч. после введения гексопреналина), генотип 16Arg/Arg не встретился ни разу (р = 0,069). Иными словами, у гомозиготных носительниц 16Arg/Arg гена ADRB2 случаев абсолютной резистентности к гексопреналину не было.
Кроме того, было показано, что пролонгации беременности от проведения курса гексопреналина до момента наступления родов у носительниц генотипа 16Arg/Arg достоверно больше, чем у носительниц аллеля 16Gly: 69 (63–79) суток и 58 (2–72) суток (в скобках даны значения Q1–Q3); р = 0,04. Также анализ пролонгации беременности (кривые выживаемости Каплана–Мейера) у носительниц генотипа 16Arg/Arg продемонстрировали заметную тенденцию к большему продлению беременности (р = 0,058). У женщин с генотипом 16Arg/Arg были достоверно лучше неонатальные исходы, наблюдались большая масса ребёнка и меньшая частота респираторных дистресс-синдромов у новорождённых, менее длительное пребывание ребёнка в больнице [27].
Таким образом, данная публикация стала первой, посвящённой фармакогенетике агонистов β2-АР у недоношенных. Впервые было показано, что гомозиготность 16Arg/Arg гена ADRB2 улучшает исход беременности после токолиза β2-адреномиметиками.
Дальнейшие исследования, подтверждающие влияние полиморфизма гена ADRB2 на состояние угрозы преждевременных родов и токолитическую терапию β2-адреномиметиками / Further studies confirming the effect of polymorphism of the ADRB2 gene on the threat of premature birth and tocolytic therapy with β2-adrenomimetics
Позже, в работе австралийских исследователей, был протестирован 31 полиморфный маркер у новорождённых с целью поиска их ассоциации со спонтанными ПР [28]. Основную группу составили дети с ДЦП, среди которых часть появилась на свет вследствие спонтанных ПР, а контрольную группу – дети без ДЦП, среди которых также часть детей родилась преждевременно. В контрольной группе была обнаружена ассоциация полиморфизма Gln27Glu гена ADRB2 у младенцев с ПР (р = 0,003). Остаётся неясным, как реализуется данная ассоциация, поскольку в данном случае генетический анализ проводили не у матери, а у ребёнка. С другой стороны, если в группе матерей с УПР чаще встречается определённый аллель гена ADRB2, то его частота может быть выше у их детей. В работе у детей без ДЦП также были установлены два полиморфизма, ассоциированные с ПР: -231C>T гена индуцибельной синтазы оксида азота (NOS2A, р = 0,042) и G127A гена тромбомодулина (THBD, p = 0,006) [28]. Результаты этой работы похожи на полученные в 2002 г. турецкими исследователями [24].
Ещё в одной работе, проведённой в Испании, были сопоставлены частоты встречаемости аллелей и генотипов четырёх полиморфизмов гена ADRB2 (-47 C>T, -20 C>T, Gly16Arg и Gln27Glu) — у 35 женщин с ПР и 105 женщин, родивших в срок. В работе не было обнаружено ассоциации между полиморфизмами гена ADRB2 и ПР, однако при небольшом объёме выборки группы с определёнными генотипами имели совсем маленькие размеры. Интересно, что из шестнадцати возможных гаплотипов в исследовании были обнаружены только три (CCGG, TTGC, TTAC), что подтверждает наследование данного гена в виде устойчивых гаплотипов [29].
Ещё в одной работе американских авторов (Miller RS et al., 2011) было показано, что полиморфизм Gly16Arg гена ADRB2 влияет на скорость раскрытия шейки матки во время родов, при этом носительство генотипа 16Arg/Arg было связано с более медленной скоростью родов (0,64±0,03 см/ч), по сравнению с двумя другими генотипами (0,8±0,02 см/ч), р = 0,001 [30]. Это наблюдение подтверждает функциональное значение аллеля 16Arg, противодействующего не только состоянию УПР, но и скорости нормального родового процесса.
В работе Park YJ et al. было изучено влияния полиморфизма гена ADRB2 на токолитическую терапию β2-адреномиметиком ритодрином [31]. Авторы определили пять полиморфизмов гена ADRB2: Gly16Arg, Gln27Glu, c.252G>A, c.523C>A и c.1053G>C у 137 женщин с УПР, принимавших ритодрин. Было обнаружено, что медиана пролонгированного срока до родов у носительниц аллеля 16Arg почти в 3 раза больше: 828 (95 % ДИ 472,39–1183,61) против 287,1 (95 % ДИ 28,35–545,91), хотя результат и не достиг статистической значимости: р = 0,089. Полиморфизм Gln27Glu не был ассоциирован с эффективностью ритодрина [31].
Интересно, что синонимичные полиморфизмы c.252 G>A и c.523 C>A также проявили тенденцию к заметной пролонгации беременности у гомозигот «дикого типа», а у гомозигот «дикого типа» c.1053GG разница пролонгации беременности оказалась достоверно выше, по сравнению с двумя альтернативными генотипами: медианы составили 1584 (95 % ДИ 0,00–3597,95) и 566 (95 % ДИ 314,53–817,47), соответственно; р = 0,019 (рис. 2).
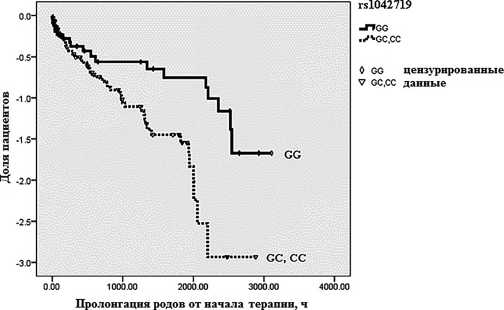
Рис. 2. Пролонгация беременности у женщин с генотипом c.1053 GG гена ADRB2 по сравнению с генотипами c.1053 GC и c.1053 CC
Figure 2. Prolongation of pregnancy in women with genotype c.1053 GG of the ADRB2 gene compared with genotypes c.1053 GC and c.1053 CC
Примечание: p = 0,019 (анализ выживаемости Каплана– Мейера) [31]
Note: p = 0.019 (Kaplan–Meyer survival analysis) [31]
Таким образом, полиморфизм гена ADRB2 может влиять на терапию ритодрином у пациентов с УПР.
В 2017 г. Chung JE et al. в ходе проспективного исследования, проведённого на кореянках с УПР (n = 186), принимавших в качестве токолитика ритодрин, показали, что нежелательные реакции (НР) на данное лекарственное средство связаны с полиморфизмом гена ADRB2 и скоростью введения препарата [32]. В исследовании генетическое тестирование было проведено по пяти полиморфизмам гена ADRB2: Gly16Arg, Gln27Glu, c.252G>A, c.523C>A и c.1053G>C. Интересно, что НР были ассоциированы не со значимыми полиморфизмами Gly16Arg и Gln27Glu, а с синонимичными. При этом у носительниц минорных аллелей НР на ритодрин не встречались, или их частота было очень низкой. Выявленные ассоциации были достоверными: c.252G>A (р = 0,009), c.523C>A (р = 0,009), c.1053G>C (р = 0,018) [32]. Надо отметить, что все три полиморфизма характеризуются значительным неравновесным сцеплением, то есть образуют устойчивые гаплотипы. Причём частоты встречаемости данных минорных аллелей оказались существенно выше у народов Азии, чем у европейцев.
Результаты исследований в России / Research results in Russia
В 2014 г. Сухих Г.Т. и др. опубликованы результаты сплошного проспективного рандомизированного исследования, проведённого в период с 2010 по 2012 гг. на базе ФГБУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова и родильного дома при городской клинической больнице № 8, включившего 103 женщины с УПР [33]. Цель исследования заключалась в изучении роли полиморфизмов генов цитокинов и β-АР в токолитической терапии β2-адреномиметиком гексопреналином. В работе не было показано ассоциации двух полиморфизмов гена ADRB2 (Gln27Glu и Thr164Ile) с пролонгированием беременности после проведённого острого токолиза. Однако в ходе исследования были обнаружены важные предикторы наступления родов менее чем через 7 дней после острого токолиза среди полиморфных вариантов других генов: BSG, IL1R1, IL1RN и VEGFA [33].
Недавно мы опубликовали результаты собственных исследований, в которых подтвердили наличие ассоциации полиморфизма Gly16Arg гена ADRB2 с УПР: у беременных с этим патологичным состоянием достоверно реже встречается аллель 16Arg (р = 0,028) и достоверно чаще — генотип 16Gly/Gly (р = 0,027) [34]. Нежелательные реакции на гексапреналин (тахикардия и головная боль) не были связаны с полиморфизмом Gly16Arg и Gln27Glu гена ADRB2. В исследовании также наблюдалась тенденция к большей эффективности гексопреналина у носительниц определённых генотипов ADRB2: так, у женщин с УПР носительниц генотипов 16Arg27Gln+16Arg27Gln, 16Gly27Glu+16Gly27Gln и 16Arg27Gln+16Gly27Gln ПР не встречались ни разу (n = 17), тогда как у женщин с УПР носительниц генотипов 16Gly27Glu+16Gly27Glu, 16Gly27Glu+16Arg27Gln и 16Gly27Gln+16Gly27Gln ПР произошли в 49 % случаев (n = 43). Это наблюдение нуждается в проверке на большей выборке.
Другие гены, влияющие на состояние угрозы преждевременных родов / Other genes affecting the threat of premature birth
К настоящему времени выявлено 119 генов-кандидатов, полиморфизм которых может быть связан с УПР [2]. Обычно полиморфизмы, увеличивающие степень или продолжительность воспалительного процесса, связаны с повышенным риском ПР, и наоборот, полиморфизмы, снижающие воспалительный ответ, связаны с пониженным риском ПР.
Так, в 1999 г. Roberts AK et al. впервые сообщили о наличии ассоциации между носительством аллеля -308A гена фактора некроза опухоли TNF и преждевременным разрывом плодных оболочек (ПРПО) [35]. Позже это открытие было подтверждено другими исследователями [36], а также было обнаружено, что наличие аллеля -308A гена TNF у плода в несколько раз повышает риск ПР.
Кроме этого, в работе была обнаружена ассоциация носительства аллеля IL1RA*2 (полиморфизм переменного числа тандемных повторов) гена антагониста рецептора интерлейкина 1 с ПРПО и последующими ПР.
Также с ПР найдены ассоциации полиморфизмов [4]:
- гена интерлейкина 1 бета IL1β (3953: А против GG) ОШ = 2,2 (95 % ДИ 1,0–5,0), р = 0,026;
- гена интерлейкина 4 IL4 (-590: ТТ против С) ОШ = 11,2 (95% ДИ 1,2–69,5), р = 0,01;
- гена интерлейкина 6 IL6 (-174: СС против G) ОШ = 0,17 (95% ДИ 0,04–0,74);
- гена матриксной металлопротеиназы 1 MMP1 (-1607) ОШ = 2,29 (95% ДИ 1,09–4,82);
- гена матриксной металлопротеиназы 9 MMP9 (число СА-повторов: 14 против 15–24) ОШ = 3,06 (95% ДИ 1,77–5,27);
- гена Toll-подобного рецептора TLR4 (Asp299Gly: Gly против 299Asp/Asp) ОШ = 1,64;
- гена фактора роста эндотелия сосудов VEGF (936: TT против С) ОШ = 2,05 (95 % ДИ 1,37–3,06).
В опубликованном в 2009 г. обзоре американских исследователей в числе генов-кандидатов ADRB2 не упоминается [37]. Авторы выделяют две группы генов ассоциированных с ПР:
- гены, связанные с ответом на инфекционный или воспалительный процесс;
- гены, участвующие в синтезе и деградация внеклеточного матрикса.
Особое внимание уделяется изменчивости генов провоспалительных и противовоспалительных цитокинов и их рецепторов, поскольку эти цитокины увеличивают экспрессию разрушающих матрикс металлопротеиназ [37].
Проведённый позднее полногеномный поиск ассоциаций (GWAS) у 43 568 женщин позволил выявить четыре гена, достоверно ассоциированные с ПР [12]:
- EBF1, кодирующий транскрипционный фактор EBF1;
- EEFSEC, кодирующий факторов элонгации трансляции eEFSec;
- AGTR2, кодирующий рецептор ангиотензина II второго типа;
- WNT4, кодирующий белок, участвующий в регуляции развития организма по женскому типу.
Заключение / Conclusion
Несмотря на то, что генетические факторы, связанные с ПР, остаются малоизученными, в настоящее время есть целый ряд генетических вариантов, носительство которых матерью влияют на риск возникновения у неё УПР и вероятность ПР. Сложность исследования этих факторов обусловлена многофакториальностью генеза данного состояния, и исследователи при изучении генетических факторов должны максимально полно исключить из выборки всех пациенток с УПР и/или со спонтанными ПР, причины которых ясны и являются негенетическими.
В ряде работ показана ассоциация полиморфизмов гена ADRB2 с ПР, а также с эффективностью токолитической терапии с помощью β2-адреномиметиков. При этом во многих из них была обнаружена ассоциация с ПР полиморфизма Gly16Arg, однако в двух работах — полиморфизма Gln27Glu. Мы склоняемся в пользу большей клинической значимости полиморфизма Gly16Arg, но существование данного гена в виде устойчивых гаплотипов усложняет наши представления о предмете исследования.
Неоднократно было показано, что носительство генотипа 16Arg/Arg ассоциировано с пониженным риском состояния УПР, спонтанными ПР, а также с повышенной эффективностью β2-адреномиметиков. Поскольку данный генотип достаточно редок, о его исключительной пользе нельзя говорить без подробного изучения. Было показано, что данный генотип обусловливает более медленное протекание нормальных родов. Можно предположить, что его носительство, обусловливая фенотип с меньшим тонусом гладких мышечных клеток, связан не только с преимуществами, но и может нести вероятные негативные последствия.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors state that there is no conflict of interest.
Участие авторов. Казаков Р. Е. – разработка концепции статьи, написание отдельных разделов; Чилова Р. А. – анализ данных литературы, научное редактирование текста; Акопов К. О. – сбор литературной информации, профессиональная корректировка текста; Сокова Е. А. – дизайн исследования, написание отдельных разделов.
Participation of authors. Kazakov RE – development of the concept of the article, writing of separate sections; Chilova RA – analysis of literary data, scientific text editing; Akopov KO – collection of literary information, professional text correction; Sokova EA – research design, writing of separate sections.
Список литературы
1. Blencowe H, Krasevec J, de Onis M et al. National, regional, and worldwide estimates of low birthweight in 2015, with trends from 2000: a systematic analysis. Lancet Glob Health. 2019 Jul;7(7):e849-e860. DOI: 10.1016/S2214-109X(18)30565-5.
2. Sheikh IA, Ahmad E, Jamal MS et al. Spontaneous preterm birth and single nucleotide gene polymorphisms: a recent update. BMC Genomics. 2016;17(Suppl 9):759. DOI: 10.1186/s12864-016-3089-0.
3. Goldenberg RL, Culhane JF, Iams JD, Romero R. Epidemiology and causes of preterm birth. Lancet. 2008 Jan 5;371(9606):75–84. DOI: 10.1016/S0140-6736(08)60074-4.
4. Crider KS, Whitehead N, Buus RM. Genetic variation associated with preterm birth: A HuGE. Genet Med. 2005 Nov-Dec;7(9):593–604. DOI: 10.1097/01.gim.0000187223.69947.db.
5. Ip M, Peyman E, Lohsoonthorn V et al. A Case-Control Study of Preterm Delivery Risk Factors According to Clinical Subtypes and Severity. J Obstet Gynaecol Res. 2010 February; 36(1):34–44. DOI:10.1111/ j.1447-0756.2009.01087.x.
6. Varner MW, Esplin MS. Current understanding of genetic factors in preterm birth. BJOG. 2005 Mar;112 Suppl 1:28–31. DOI: 10.1111/ j.1471-0528.2005.00581.x.
7. Plunkett J, Muglia LJ. Genetic contributions to preterm birth: implications from epidemiological and genetic association studies. Ann Med. 2008;40(3):167–195. DOI: 10.1080/07853890701806181.
8. Plunkett J, Borecki I, Morgan T, Stamilio D, Muglia LJ. Populationbased estimate of sibling risk for preterm birth, preterm premature rupture of membranes, placental abruption and pre-eclampsia. BMC Genet. 2008;9:44. DOI: 10.1186/1471-2156-9-44.
9. Weinberg CR, Shi M. The genetics of preterm birth: using what we know to design better association studies. Am J Epidemiol. 2009;170(11):1373–1381. DOI: 10.1093/aje/kwp325.
10. Treloar SA, Macones GA, Mitchell LE, Martin NG. Genetic influences on premature parturition in an Australian twin sample. Twin Res. 2000;3(2): 80–82. DOI: 10.1375/136905200320565526.
11. York TP, Eaves LJ, Lichtenstein P et al. Fetal and maternal genes’ influence on gestational age in a quantitative genetic analysis of 244,000 Swedish births. Am J Epidemiol. 2013 Aug 15;178(4):543–550. DOI: 10.1093/aje/kwt005.
12. Zhang G, Feenstra B, Bacelis J et al. Genetic Associations with Gestational Duration and Spontaneous Preterm Birth. N Engl J Med. 2017;377(12):1156–1167. DOI: 10.1056/NEJMoa1612665.
13. Савельева О.Н., Карунас А.С., Федорова Ю.Ю., Хуснутдинова Э.К. Роль полиморфных вариантов гена β2-адренергического рецептора (ADRB2) в развитии и течении бронхиальной астмы. Медицинский вестник Башкортостана. 2018;13(5(77)):69–75.
14. Hopes E, McDougall C, Christie G et al. Association of glutamine 27 polymorphism of beta 2 adrenoceptor with reported childhood asthma: population based study. BMJ. 1998 Feb 28;316(7132):664. DOI: 10.1136/bmj.316.7132.664.
15. Ishiyama-Shigemoto S, Yamada K et al. Association of polymorphisms in the β2-adrenergic receptor gene with obesity, hypertriglyceridaemia, and diabetes mellitus. Diabetologia. 1999; 42(1):98–101. DOI: 10.1007/s001250051120.
16. Bray MS, Krushkal J, Li L et al. Positional genomic analysis identifies the β2-adrenergic receptor gene as a susceptibility locus for human hypertension. Circulation. 2000 Jun 27;101(25):2877–2882. DOI: 10.1161/01.cir.101.25.2877.
17. Cagliani R, Fumagalli M, Pozzoli U et al. Diverse evolutionary histories for beta-adrenoreceptor genes in humans. Am J Hum Genet. 2009;85(1):64–75. DOI: 10.1016/j.ajhg.2009.06.005.
18. Dishy V, Sofowora GG, Xie HG et al. The effect of common polymorphisms of the beta2-adrenergic receptor on agonist-mediated vascular desensitization. N Engl J Med. 2001; 345(14):1030–1035. DOI: 10.1056/NEJMoa010819.
19. Landau R, Xie HG, Dishy V et al. Beta2-Adrenergic receptor genotype and preterm delivery. Am J Obstet Gynecol. 2002 Nov;187(5):1294–1298. DOI: 10.1067/mob.2002.128524.PMID: 12439523.
20. Drysdale CM, McGraw DW, Stack CB et al. Complex promoter and coding region beta 2-adrenergic receptor haplotypes alter receptor expression and predict in vivo responsiveness. Proc Natl Acad Sci U S A. 2000 Sep 12;97(19):10483–10488. DOI: 10.1073/pnas.97.19.10483.
21. Ratge D, Wiedemann A, Kohse KP, Wisser H. Alterations of betaadrenoceptors on human leukocyte subsets induced by dynamic exercise: effect of prednisone. Clin Exp Pharmacol Physiol. 1988;15(1):43–53. DOI: 10.1111/j.1440-1681.1988.tb01007.x.
22. Murray DR, Irwin M, Rearden CA et al. Sympathetic and immune interactions during dynamic exercise. Mediation via a beta2-adrenergicdependent mechanism. Circulation. 1992; 86(1):203–213. DOI: 10.1161/01.cir.86.1.203.
23. Panebra A, Wang WC, Malone MM et al. Common ADRB2 haplotypes derived from 26 polymorphic sites direct beta2-adrenergic receptor expression and regulation phenotypes. PLoS One. 2010;5(7): e11819. DOI: 10.1371/journal.pone.0011819.
24. Ozkur M, Dogulu F, Ozkur A et al. Association of the Gln27Glu polymorphism of the beta-2-adrenergic receptor with preterm labor. Int J Gynaecol Obstet. 2002;77(3):209–215. DOI: 10.1016/s0020-7292(02)00035-8.
25. Doh K, Sziller I, Vardhana S. Beta2-adrenergic receptor gene polymorphisms and pregnancy outcome. J Perinat Med. 2004;32(5):413–417. DOI: 10.1515/JPM.2004.138.
26. Lima JJ, Thomason DB, Mohamed MH et al. Impact of genetic polymorphisms of the beta2-adrenergic receptor on albuterol bronchodilator pharmacodynamics. Clin Pharmacol Ther. 1999; 65(5):519–525. DOI: 10.1016/S0009-9236(99)70071-8.
27. Landau R, Morales MA, Antonarakis SE et al. Arg16 homozygosity of the beta2-adrenergic receptor improves the outcome after beta2-agonist tocolysis for preterm labor. Clin Pharmacol Ther. 2005;78(6):656–663. DOI: 10.1016/j.clpt.2005.08.021.
28. Gibson CS, maclennan AH, Dekker GA et al. Genetic polymorphisms and spontaneous preterm birth. Obstet Gynecol. 2007 Feb;109(2 Pt 1):384–391. DOI: 10.1097/01.AOG.0000252712.62241.1a.
29. Ríos JC, McEwen JG, Cuartas A et al. Evaluación del efecto de cuatro polimorfismos en el gen del receptor adrenérgico β2 en el parto pretérmino. Colomb Med. 2008;39:7-15. [Ríos JC, McEwen JG, Cuartas A et al. Role of four polymorphisms of the β-2 adrenergic receptor gen in patients with preterm delivery. Colomb Med. 2008;39:7–15. (In Spanish).].
30. Miller RS, Smiley RM, Daniel D et al. Beta-2 adrenoceptor genotype and progress in term and late preterm active labor. Am J Obstet Gynecol. 2011;205(2):137.e1–7. DOI: 10.1016/j.ajog.2011.03.045.
31. Park YJ, Lee NR, Lee KE et al. Effects of β2-Adrenergic Receptor Gene Polymorphisms on Ritodrine Therapy in Pregnant Women with Preterm Labor: Prospective Follow-Up Study. Int J Mol Sci. 2014. 21;15(7):12885–12894. DOI: 10.3390/ijms150712885.
32. Chung JE, Choi SA, Hwang HS et al. Association between β2- adrenergic receptor gene polymorphisms and adverse events of ritodrine in the treatment of preterm labor: a prospective observational study. BMC Genet. 2017 Nov 13;18(1):96. DOI: 10.1186/s12863-017-0565-8.
33. Сухих Г.Т., Ходжаева З.С., Донников А.Е. и др. Молекулярно-генетические предикторы эффективности токолитической терапии в пролонгировании беременности при угрожающих преждевременных родах. Акушерство и гинекология. 2014;2:27–34.
34. Проклова Г.Ф., Сокова Е.А., Казаков Р.Е., Чилова Р.А., Жукова Э.В., Акопов К.О. Полиморфизм гена ADRB2 как предиктор преждевременных родов. Вопросы гинекологии, акушерства и перинатологии. 2021;20(2):5–12.
35. Roberts AK, Monzon-Bordonaba F, Van Deerlin PG et al. Association of polymorphism within the promoter of the tumor necrosis factor alpha gene with increased risk of preterm premature rupture of the fetal membranes. Am J Obstet Gynecol. 1999;180(5):1297–1302. DOI: 10.1016/s0002-9378(99)70632-0.
36. Moore S, Ide M, Randhawa M et al. An investigation into the association among preterm birth, cytokine gene polymorphisms and periodontal disease. BJOG. 2004;111(2):125–132. DOI: 10.1046/ j.1471-0528.2003.00024.x-i1.
37. Anum EA, Hill LD, Pandya A, Strauss JF. Connective tissue and related disorders and preterm birth: clues to genes contributing to prematurity. Placenta. 2009;30(3):207–215. DOI: 10.1016/j.placenta.2008.12.007.
Об авторах
Р. Е. КазаковРоссия
Казаков Руслан Евгеньевич, к. б. н., начальник отдела персонализированной медицины и клинической фармакогенетики
Москва
Р. А. Чилова
Россия
Чилова Раиса Алексеевна, д. м. н., доцент, профессор кафедры акушерства и гинекологии
Москва
К. О. Акопов
Россия
Акопов Константин Олегович, врач акушер-гинеколог
Москва
Е. А. Сокова
Россия
Сокова Елена Андреевна, к. м. н., доцент; ведущий аналитик
Москва
Рецензия
Для цитирования:
Казаков Р.Е., Чилова Р.А., Акопов К.О., Сокова Е.А. Полиморфизм гена ADRB2 и состояние угрозы преждевременных родов. Фармакогенетика и фармакогеномика. 2021;(1):9-17. https://doi.org/10.37489/2588-0527-2021-1-9-17
For citation:
Kazakov R.E., Chilova R.A., Akopov K.O., Sokova E.A. ADRB2 gene polymorphism and preterm labor. Pharmacogenetics and Pharmacogenomics. 2021;(1):9-17. (In Russ.) https://doi.org/10.37489/2588-0527-2021-1-9-17
JATS XML











































